Zidentyfikuj elementy składowe materii
Na swoim najbardziej podstawowym poziomie, życie składa się z materii. Materia to każda substancja, która zajmuje przestrzeń i ma masę. Pierwiastki są unikalnymi formami materii o specyficznych właściwościach chemicznych i fizycznych, których nie można rozłożyć na mniejsze substancje w zwykłych reakcjach chemicznych. Istnieje 118 pierwiastków, ale tylko 92 występują naturalnie. Pozostałe pierwiastki są syntetyzowane w laboratoriach i są niestabilne.
Każdy pierwiastek jest oznaczany przez swój symbol chemiczny, który jest pojedynczą wielką literą lub, gdy pierwsza litera jest już „zajęta” przez inny pierwiastek, kombinacją dwóch liter. Niektóre pierwiastki są zgodne z angielskim terminem dla danego pierwiastka, np. C dla węgla i Ca dla wapnia. Symbole chemiczne innych pierwiastków pochodzą od ich nazw łacińskich; na przykład symbol sodu to Na, odnoszący się do natrium, łacińskiego słowa oznaczającego sód.
Cztery pierwiastki wspólne dla wszystkich organizmów żywych to tlen (O), węgiel (C), wodór (H) i azot (N). W świecie nieożywionym pierwiastki występują w różnych proporcjach, a niektóre z nich, wspólne dla organizmów żywych, są stosunkowo rzadkie na całej Ziemi, jak pokazano w tabeli 1. Na przykład atmosfera jest bogata w azot i tlen, ale zawiera mało węgla i wodoru, natomiast skorupa ziemska, choć zawiera tlen i niewielką ilość wodoru, ma mało azotu i węgla. Pomimo różnic w obfitości, wszystkie pierwiastki i zachodzące między nimi reakcje chemiczne podlegają tym samym prawom chemicznym i fizycznym niezależnie od tego, czy są częścią świata ożywionego czy nieożywionego.
| Tabela 1. Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, i jak te czynniki wpływają na tworzenie wiązań między atomami
Atomy
Struktura atomu
Aby zrozumieć, jak pierwiastki łączą się ze sobą, musimy najpierw omówić najmniejszy składnik lub budulec pierwiastka, atom. Atom jest najmniejszą jednostką materii, która zachowuje wszystkie właściwości chemiczne danego pierwiastka. Na przykład, jeden atom złota posiada wszystkie właściwości złota w tym, że jest stałym metalem w temperaturze pokojowej. Złota moneta to po prostu bardzo duża liczba atomów złota uformowanych w kształt monety i zawierających niewielkie ilości innych pierwiastków zwanych zanieczyszczeniami. Atomy złota nie mogą być rozbite na nic mniejszego, zachowując przy tym właściwości złota.
Atom składa się z dwóch regionów: jądra, które znajduje się w centrum atomu i zawiera protony i neutrony, oraz najbardziej zewnętrznego regionu atomu, który utrzymuje elektrony na orbicie wokół jądra, jak pokazano na rysunku 1. Atomy zawierają protony, elektrony i neutrony, wśród innych cząstek subatomowych. Jedynym wyjątkiem jest wodór (H), który jest zbudowany z jednego protonu i jednego elektronu bez neutronów.

Rysunek 1. Pierwiastki, takie jak przedstawiony tu hel, zbudowane są z atomów. Atomy składają się z protonów i neutronów znajdujących się w jądrze, z elektronami na orbitalach otaczających jądro.
Protony i neutrony mają w przybliżeniu taką samą masę, około 1,67 × 10-24 grama. Naukowcy arbitralnie określają tę ilość masy jako jedną atomową jednostkę masy (amu) lub jeden dalton, jak pokazano w tabeli 1. Chociaż protony i neutrony mają podobną masę, różnią się ładunkiem elektrycznym. Proton jest naładowany dodatnio, podczas gdy neutron jest nienaładowany. Dlatego liczba neutronów w atomie ma znaczący wpływ na jego masę, ale nie na jego ładunek. Elektrony mają znacznie mniejszą masę niż protony, ważą tylko 9,11 × 10-28 grama, czyli około 1/1800 jednostki masy atomowej. W związku z tym nie wnoszą one wiele do całkowitej masy atomowej pierwiastka. Dlatego też, rozważając masę atomową, zwyczajowo ignoruje się masę elektronów i oblicza masę atomu na podstawie liczby samych protonów i neutronów. Chociaż elektrony nie mają znaczącego wpływu na masę, to jednak w znacznym stopniu przyczyniają się do ładunku atomu, ponieważ każdy elektron ma ładunek ujemny równy ładunkowi dodatniemu protonu. W nienaładowanych, neutralnych atomach, liczba elektronów krążących wokół jądra jest równa liczbie protonów w jądrze. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | jądro |
| Elektron | -1 | 0 | orbitale |
Liczba atomowa i masa
Atomy każdego pierwiastka zawierają charakterystyczną liczbę protonów i elektronów. Liczba protonów określa liczbę atomową pierwiastka i jest używana do odróżnienia jednego pierwiastka od drugiego. Liczba neutronów jest zmienna, co prowadzi do powstania izotopów, czyli różnych form tego samego atomu, różniących się jedynie liczbą posiadanych neutronów. Liczba protonów i liczba neutronów łącznie określają liczbę masową pierwiastka, jak pokazano na rysunku 2. Zauważmy, że niewielki wkład masy pochodzący od elektronów nie jest brany pod uwagę przy obliczaniu liczby masowej. Takie przybliżenie masy może być wykorzystane do łatwego obliczenia liczby neutronów, poprzez proste odjęcie liczby protonów od liczby masowej. Ponieważ izotopy danego pierwiastka będą miały nieco inne liczby masowe, naukowcy określają również masę atomową, która jest obliczoną średnią liczby masowej dla jego naturalnie występujących izotopów. Często otrzymana liczba zawiera ułamek. Na przykład, masa atomowa chloru (Cl) wynosi 35.45, ponieważ chlor składa się z kilku izotopów, niektórych (większość) o masie atomowej 35 (17 protonów i 18 neutronów) i niektórych o masie atomowej 37 (17 protonów i 20 neutronów).
Praktyczne pytanie
Węgiel ma liczbę atomową sześć i dwa stabilne izotopy o liczbie masowej odpowiednio dwanaście i trzynaście. Jego masa atomowa wynosi 12,11.

Rysunek 2. Węgiel-12 i węgiel-13
Ile neutronów mają odpowiednio węgiel-12 i węgiel-13?
Układ okresowy pierwiastków
Różne pierwiastki są uporządkowane i przedstawione w układzie okresowym. Opracowany przez rosyjskiego chemika Dmitrija Mendelejewa (1834-1907) w 1869 r., układ grupuje pierwiastki, które, choć unikalne, mają pewne wspólne właściwości chemiczne z innymi pierwiastkami. Właściwości pierwiastków odpowiadają za ich stan fizyczny w temperaturze pokojowej: mogą być gazami, ciałami stałymi lub cieczami. Pierwiastki mają również specyficzną reaktywność chemiczną, zdolność do łączenia się i wiązania chemicznego ze sobą.
W układzie okresowym, przedstawionym na rysunku 3, pierwiastki są uporządkowane i wyświetlane zgodnie z ich liczbą atomową i są ułożone w szeregu rzędów i kolumn w oparciu o wspólne właściwości chemiczne i fizyczne. Oprócz podania liczby atomowej dla każdego pierwiastka, układ okresowy wyświetla również jego masę atomową. Patrząc na węgiel, na przykład, jego symbol (C) i nazwa pojawiają się, jak również jego liczba atomowa wynosząca sześć (w lewym górnym rogu) i jego masa atomowa wynosząca 12,11.

Rysunek 3. W układzie okresowym podano masę atomową i liczbę atomową każdego pierwiastka. Liczba atomowa pojawia się nad symbolem pierwiastka, a przybliżona masa atomowa pojawia się pod nim.
Układ okresowy grupuje pierwiastki według właściwości chemicznych. Różnice w reaktywności chemicznej pomiędzy pierwiastkami są oparte na liczbie i przestrzennym rozmieszczeniu elektronów w atomie. Atomy, które reagują chemicznie i łączą się ze sobą, tworzą cząsteczki. Cząsteczki to po prostu dwa lub więcej atomów połączonych ze sobą chemicznie. Logicznie rzecz biorąc, kiedy dwa atomy łączą się chemicznie tworząc cząsteczkę, ich elektrony, które tworzą najbardziej zewnętrzny obszar każdego atomu, łączą się najpierw, gdy atomy tworzą wiązanie chemiczne.
Oglądnij ten film, aby uzyskać bardziej dogłębne wprowadzenie do układu okresowego:
Elektrony
Powłoki elektronowe i model Bohra

Rysunek 4. Model Bohra.
Należy podkreślić, że istnieje związek pomiędzy liczbą protonów w pierwiastku, czyli liczbą atomową, która odróżnia jeden pierwiastek od drugiego, a liczbą posiadanych przez niego elektronów. We wszystkich obojętnych elektrycznie atomach liczba elektronów jest taka sama jak liczba protonów. Tak więc każdy pierwiastek, przynajmniej gdy jest elektrycznie obojętny, ma charakterystyczną liczbę elektronów równą swojej liczbie atomowej.
Wczesny model atomu został opracowany w 1913 roku przez duńskiego naukowca Nielsa Bohra (1885-1962). W tym modelu, elektrony istnieją w głównych powłokach. Elektron normalnie istnieje w powłoce o najniższej dostępnej energii, która jest najbliżej jądra. Energia pochodząca z fotonu światła może przesunąć go do powłoki o wyższej energii, ale taka sytuacja jest niestabilna i elektron szybko rozpada się z powrotem do stanu podstawowego. W procesie tym uwalniany jest foton światła.
Model Bohra przedstawia atom jako centralne jądro zawierające protony i neutrony, z elektronami na orbitach kołowych w określonych odległościach od jądra, jak pokazano na rysunku 4. Orbity te tworzą powłoki elektronowe lub poziomy energetyczne, które są sposobem wizualizacji liczby elektronów w najbardziej zewnętrznych powłokach. Te poziomy energetyczne są oznaczone liczbą i symbolem „n”. Na przykład, 1n reprezentuje pierwszy poziom energetyczny znajdujący się najbliżej jądra.
Elektrony wypełniają orbitale w spójnej kolejności: najpierw wypełniają orbitale najbliżej jądra, następnie kontynuują wypełnianie orbitali o rosnącej energii dalej od jądra. Jeśli istnieje wiele orbitali o równej energii, będą one wypełnione jednym elektronem na każdym poziomie energetycznym zanim zostanie dodany drugi elektron. Elektrony na najbardziej zewnętrznym poziomie energetycznym określają stabilność energetyczną atomu i jego skłonność do tworzenia wiązań chemicznych z innymi atomami w celu utworzenia cząsteczek.
W standardowych warunkach, atomy wypełniają najpierw wewnętrzne powłoki, często powodując zmienną liczbę elektronów w najbardziej zewnętrznej powłoce. Najbardziej wewnętrzna powłoka ma maksymalnie dwa elektrony, ale następne dwie powłoki elektronowe mogą mieć maksymalnie po osiem elektronów. Jest to znane jako reguła oktetu, która mówi, z wyjątkiem najbardziej wewnętrznej powłoki, że atomy są bardziej stabilne energetycznie, gdy mają osiem elektronów w swojej powłoce walencyjnej, najbardziej zewnętrznej powłoce elektronowej. Przykłady niektórych neutralnych atomów i ich konfiguracji elektronowych pokazane są na rysunku 5. Zauważmy, że na tym rysunku hel ma kompletną zewnętrzną powłokę elektronową, z dwoma elektronami wypełniającymi jego pierwszą i jedyną powłokę. Podobnie, neon ma kompletną zewnętrzną powłokę 2n zawierającą osiem elektronów. Dla kontrastu, chlor i sód mają odpowiednio siedem i jeden w swoich zewnętrznych powłokach, ale teoretycznie byłyby bardziej stabilne energetycznie, gdyby stosowały się do zasady oktetu i miały osiem.
Pytanie praktyczne
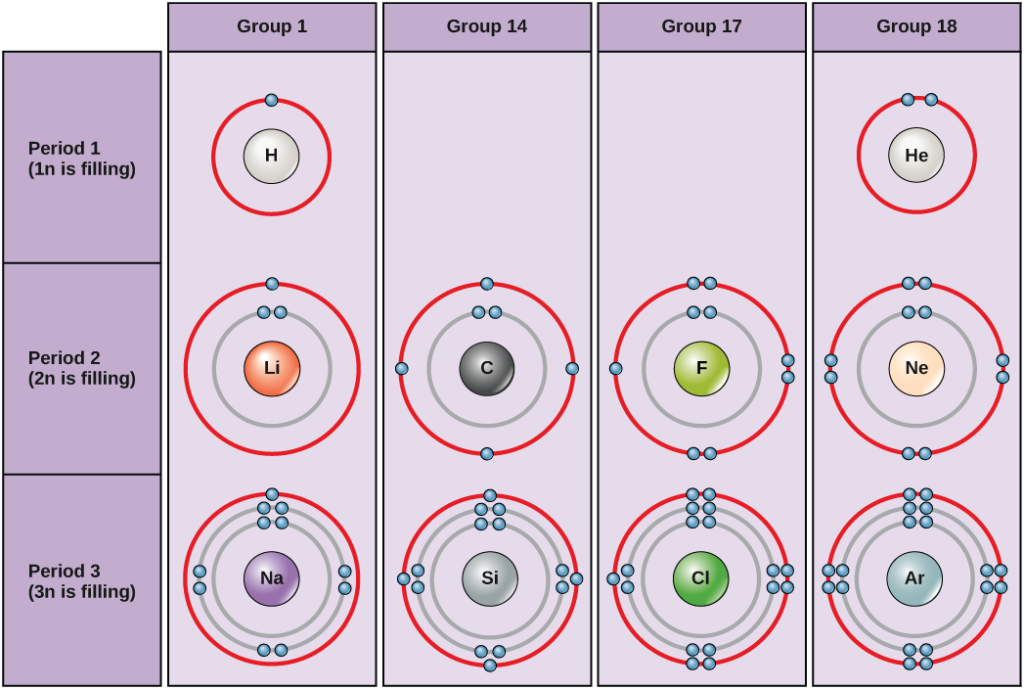
Rysunek 5. Schematy Bohra dla wodoru, helu, litu, węgla, fluoru, neonu, sodu, krzemu, chloru i argonu.
Schematy Bohra wskazują, ile elektronów wypełnia każdą powłokę główną. Pierwiastki grupy 18 (hel, neon i argon są pokazane na rysunku 5) mają pełną zewnętrzną powłokę walencyjną. Pełna powłoka walencyjna jest najbardziej stabilną konfiguracją elektronową. Pierwiastki w innych grupach mają częściowo wypełnione powłoki walencyjne i zyskują lub tracą elektrony aby osiągnąć stabilną konfigurację elektronową.
Atom może dawać, brać lub dzielić elektrony z innym atomem aby osiągnąć pełną powłokę walencyjną, najbardziej stabilną konfigurację elektronową. Patrząc na ten rysunek, ile elektronów muszą stracić pierwiastki z grupy 1 aby osiągnąć stabilną konfigurację elektronową? Ile elektronów muszą zdobyć pierwiastki z grup 14 i 17, aby osiągnąć stabilną konfigurację?
Zrozumienie, że organizacja układu okresowego jest oparta na całkowitej liczbie protonów (i elektronów) pomaga nam wiedzieć, jak elektrony są rozmieszczone w zewnętrznej powłoce. Układ okresowy jest ułożony w kolumnach i rzędach w oparciu o liczbę elektronów i miejsca ich rozmieszczenia. Przyjrzyj się bliżej niektórym pierwiastkom w prawej kolumnie układu okresowego na rysunku 3.
Atomy z grupy 18: hel (He), neon (Ne) i argon (Ar) mają wypełnione zewnętrzne powłoki elektronowe, co sprawia, że nie muszą dzielić się elektronami z innymi atomami, aby osiągnąć stabilność; są bardzo stabilne jako pojedyncze atomy. Ich niereaktywność spowodowała, że nazwano je gazami obojętnymi (lub szlachetnymi). Porównaj to z pierwiastkami grupy 1, znajdującymi się w lewej kolumnie. Wszystkie te pierwiastki, w tym wodór (H), lit (Li) i sód (Na), posiadają po jednym elektronie w swoich najbardziej zewnętrznych powłokach. Oznacza to, że mogą one osiągnąć stabilną konfigurację i wypełnioną powłokę zewnętrzną poprzez oddanie lub współdzielenie jednego elektronu z innym atomem lub cząsteczką taką jak woda. Wodór odda lub podzieli się swoim elektronem, aby osiągnąć taką konfigurację, podczas gdy lit i sód oddadzą swój elektron, aby stać się stabilnymi. W wyniku utraty ujemnie naładowanego elektronu, stają się one dodatnio naładowanymi jonami. Pierwiastki grupy 17, w tym fluor i chlor, mają siedem elektronów w swoich skrajnych powłokach, więc mają tendencję do wypełniania tej powłoki elektronem z innych atomów lub cząsteczek, co czyni je ujemnie naładowanymi jonami. Pierwiastki grupy 14, z których węgiel jest najważniejszy dla systemów żywych, mają cztery elektrony w swojej zewnętrznej powłoce, co pozwala im na tworzenie kilku wiązań kowalencyjnych (omówionych poniżej) z innymi atomami. Tak więc, kolumny układu okresowego reprezentują potencjalny wspólny stan zewnętrznych powłok elektronowych tych pierwiastków, który jest odpowiedzialny za ich podobne właściwości chemiczne.
Orbitale elektronowe
Ale przydatne do wyjaśnienia reaktywności i wiązań chemicznych niektórych pierwiastków, model Bohra atomu nie odzwierciedla dokładnie jak elektrony są rozmieszczone przestrzennie wokół jądra. Nie kr±ż± one wokół j±dra jak ziemia wokół słońca, ale znajduj± się w orbitalach elektronowych. Te stosunkowo skomplikowane kształty wynikają z faktu, że elektrony zachowują się nie tylko jak cząstki, ale także jak fale. Równania matematyczne z mechaniki kwantowej znane jako funkcje falowe mogą przewidzieć z pewnym prawdopodobieństwem, gdzie elektron może się znaleźć w danym momencie. Obszar, w którym elektron najprawdopodobniej się znajdzie nazywany jest jego orbitalem.

Rysunek 6. Kliknij, aby powiększyć obraz. Podpowłoki s mają kształt kuli. Zarówno powłoki główne 1n jak i 2n posiadają orbital s, ale rozmiar sfery jest większy w przypadku orbitalu 2n. Każda sfera jest pojedynczym orbitalem. podpowłoki p składają się z trzech orbitali w kształcie hantli. Główna powłoka 2n ma podpowłokę p, ale powłoka 1 nie.
Przypomnijmy, że model Bohra przedstawia konfigurację powłoki elektronowej atomu. W ramach każdej powłoki elektronowej s± podpowłoki, a każda podpowłoka ma okre¶lon± liczbę orbitali zawieraj±cych elektrony. Podczas gdy niemożliwe jest dokładne obliczenie, gdzie znajduje się elektron, naukowcy wiedzą, że najprawdopodobniej znajduje się on w obrębie swojej ścieżki orbitalnej. Podpowłoki oznaczane są literami s, p, d, i f. Podpowłoka s ma kształt kulisty i posiada jeden orbital. Główna powłoka 1n ma tylko jeden orbital s, który może pomieścić dwa elektrony. Główna powłoka 2n ma jedną podpowłokę s i jedną podpowłokę p, i może pomieścić w sumie osiem elektronów. Podpowłoka p ma trzy orbitale w kształcie hantli, jak pokazano na rysunku 6. Powłoki d i f mają bardziej złożone kształty i zawierają odpowiednio pięć i siedem orbitali. Nie są one pokazane na ilustracji. Główna powłoka 3n posiada podpowłoki s, p, i d i może pomieścić 18 elektronów. Główna powłoka 4n ma orbitale s, p, d i f i może pomieścić 32 elektrony. Oddalając się od jądra, liczba elektronów i orbitali znajdujących się na poziomach energetycznych wzrasta. Przechodząc od jednego atomu do następnego w układzie okresowym, struktura elektronowa może być opracowana przez dopasowanie dodatkowego elektronu do następnego dostępnego orbitalu.
Orbital najbliższy jądru, zwany orbitalem 1s, może pomieścić do dwóch elektronów. Orbital ten jest odpowiednikiem najbardziej wewnętrznej powłoki elektronowej w modelu Bohra atomu. Jest on nazywany orbitalem 1s, ponieważ jest sferyczny wokół jądra. Orbital 1s jest najbliższym orbitalem w stosunku do jądra i zawsze jest wypełniany jako pierwszy, zanim jakikolwiek inny orbital może być wypełniony. Wodór posiada jeden elektron, dlatego ma zajęte tylko jedno miejsce w orbitalu 1s. Jest to oznaczane jako 1s1, gdzie indeks 1 odnosi się do jednego elektronu w orbitalu 1s. Hel posiada dwa elektrony, dlatego może całkowicie wypełnić orbital 1s swoimi dwoma elektronami. Jest to oznaczane jako 1s2, odnosząc się do dwóch elektronów helu na orbitalu 1s. Na rysunku 6 układu okresowego wodór i hel są jedynymi dwoma pierwiastkami w pierwszym rzędzie (okresie); dzieje się tak dlatego, że posiadają one tylko elektrony w swojej pierwszej powłoce, czyli na orbitalu 1s. Wodór i hel są jedynymi dwoma pierwiastkami, które mają orbitale 1s i żadnych innych orbitali elektronowych w stanie elektrycznie obojętnym.
Druga powłoka elektronowa może zawierać osiem elektronów. Ta powłoka zawiera kolejny kulisty orbital s i trzy orbitale p w kształcie „hantli”, z których każdy może pomieścić dwa elektrony, jak pokazano na Rysunku 6. Po zapełnieniu orbitalu 1s, zapełniana jest druga powłoka elektronowa, najpierw zapełniany jest orbital 2s, a następnie trzy orbitale p. Podczas wypełniania orbitali p, każdy z nich przyjmuje jeden elektron; gdy każdy z orbitali p posiada elektron, można dodać drugi. Lit (Li) zawiera trzy elektrony, które zajmują pierwszą i drugą powłokę. Dwa elektrony wypełniają orbital 1s, a trzeci elektron wypełnia orbital 2s. Jego konfiguracja elektronowa to 1s22s1. Neon (Ne), z drugiej strony, ma w sumie dziesięć elektronów: dwa znajdują się na najbardziej wewnętrznym orbitalu 1s, a osiem wypełnia jego drugą powłokę (po dwa na orbitalu 2s i trzech p); dlatego jest gazem obojętnym i jest energetycznie stabilny jako pojedynczy atom, który rzadko będzie tworzył wiązania chemiczne z innymi atomami. Większe pierwiastki mają dodatkowe orbitale, tworzące trzecią powłokę elektronową. Chociaż pojęcia powłoki elektronowej i orbitali są blisko spokrewnione, orbitale zapewniają dokładniejsze przedstawienie konfiguracji elektronowej atomu, ponieważ model orbitalny określa różne kształty i specjalne orientacje wszystkich miejsc, które elektrony mogą zajmować.
Obejrzyj tę wizualną animację, aby zobaczyć przestrzenne rozmieszczenie orbitali p i s. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.