Elektrolit to związek chemiczny, który dysocjuje na jony i dlatego jest zdolny do przenoszenia ładunku elektrycznego – tzn. elektrolit jest przewodnikiem elektrycznym; w przeciwieństwie do metali przepływ ładunku nie jest przepływem elektronów, ale jest ruchem jonów.
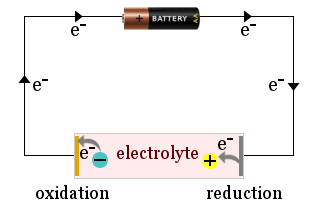
Na przykład, schemat przedstawia domową baterię używaną do przyciągania jonów elektrolitu do elektrod ogniwa elektrochemicznego, gdzie jony zyskują elektrony (są zredukowane) lub tracą elektrony (są utlenione).
Niekiedy elektrody same reagują, na przykład elektroda metalowa może zostać utleniona i uwolnić jony do elektrolitu.
Elektrolity mogą być ciałami stałymi, cieczami lub roztworami.
Przykłady elektrolitów
1. Stopiony chlorek sodu działa jako elektrolit w produkcji metalu sodowego. Powstaje również gazowy chlor.
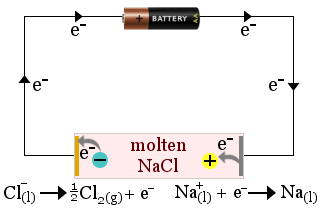 W tym przypadku elektrolit jest zużywany przez reakcje redoks w ogniwie.
W tym przypadku elektrolit jest zużywany przez reakcje redoks w ogniwie.
2. Wodorotlenek potasu rozpuszczony w wodzie wytwarza wysoce przewodzący elektrolit w ogniwie Edisona, wczesnym ogniwie wielokrotnego ładowania.
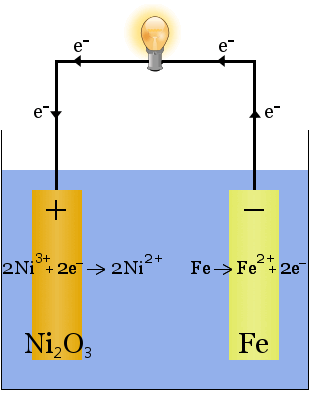
W przeciwieństwie do przypadku produkcji sodu powyżej, w tej reakcji nie jest zużywany elektrolit.Rolą wodorotlenku potasu w tym przypadku jest zwiększenie dostępności jonów w celu zwiększenia przewodności elektrolitu i zakończenia obwodu elektrycznego.
Równania chemiczne dla reakcji zachodzących na elektrodach są następujące:
Dla rozładowania równania czytamy od lewej do prawej; dla ładowania od prawej do lewej.
3. Tradycyjnie elektrolity były cieczami, aby umożliwić ruch jonów.Jednak obecnie dostępne są materiały stałe, które pozwalają jonom łatwo poruszać się przez ich struktury.Elektrolity stałe są pożądane w wielu produktach konsumenckich, ponieważ nie wyciekają.
Siarczek litowo-cynowo-fosforowy, Li10SnP2S12, jest stałym elektrolitem do stosowania w bateriach litowo-jonowych.Struktura krystaliczna stałego elektrolitu w połączeniu z jego słabym oddziaływaniem z jonami litu zapewnia środowisko, przez które jony litu mogą łatwo przeskakiwać.
4. Elektrolity mają ogromne znaczenie dla procesów elektrochemicznych w organizmach żywych.Główne jony w tych elektrolitach to wapń (Ca2+), magnez (Mg2+), sód (Na+), potas (K+), chlorek (Cl-), wodorowęglan (HCO3-) i wodorofosforan (HPO42-).
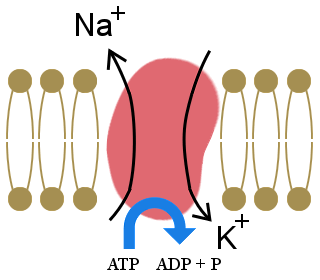
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
