Wprowadzenie
Dwa sygnały wzrokowe pojawiające się jednocześnie są wykrywane szybciej niż każdy z nich pojawiający się osobno (Hershenson, 1962; Raab, 1962). Część tego efektu nadmiarowego celu (RTE) można wyjaśnić stochastycznie za pomocą modelu „wyścigu konnego”. Oznacza to, że jeśli dwa bodźce są przetwarzane w równoległych i niezależnych kanałach, dla których szybkość przetwarzania zmienia się losowo z próby na próbę, to przy każdej prezentacji najszybszy bodziec wygrywa wyścig i osiąga próg wykrywalności, aby wywołać reakcję; dlatego średnio jest bardziej prawdopodobne, że dwa bodźce dadzą szybszą reakcję niż średni czas reakcji na jeden bodziec przetwarzany w jednym z dwóch kanałów.
Jednakże analizy rozkładów częstości skumulowanej wykazały, że istnieje dodatkowy wkład do RTE, który nie może być uwzględniony przez model konia wyścigowego między dwoma niezależnymi kanałami. Miller (1982) zaproponował model „współaktywacji”, w którym oba sygnały są sumowane w puli aktywacji. Miniussi i wsp. (1998) wykazali, że redundantne cele powodują krótsze latencje dla potencjałów mózgowych związanych ze zdarzeniem P1 i N1, co wskazuje, że neuronalna sumacja występuje we wczesnym odcinku drogi wzrokowej. Eksperymenty na pacjentach z hemianopią pokazały również, że RTE nie może być w pełni wyjaśnione przez wyścig konny do osiągnięcia progu detekcji, ponieważ RTE może być manifestowane nawet przy braku fenomenalnej świadomości jednego z dwóch bodźców (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). Rzeczywiście, u pacjentów po hemianktomii redundantny cel w polu ślepym nie tylko generuje RTE, ale RTE jest powiększone, gdy bodziec redundantny uzupełnia wzorzec gestalt (Georgy i in., 2016). Te obserwacje u hemianopików sugerują, że neuronalna sumacja zachodzi podkorowo i nie jest zależna od pierwotnej kory wzrokowej.
Kumulatywne dowody pośrednie implikowały superior colliculus (SC) jako substrat dla neuronalnej sumacji, która przyczynia się do RTE. Jednakże, bezpośrednie dowody nie zostały jeszcze przedstawione. Obecne badania badają drogę neuronalną, która przekazuje sygnały wzrokowe zintegrowane w SC. SC składa się z warstw powierzchownych i głębokich. Warstwy głębokie kolliculi otrzymują aferenty, zarówno bezpośrednie, jak i poprzez zwoje podstawy, z kory okulomotorycznej (Hikosaka i Wurtz, 1983; Pare i Wurtz, 1997; Sommer i Wurtz, 2000). Aferenty wzrokowe do powierzchownych warstw obojczyka są natomiast przekazywane zarówno z siatkówki (poprzez drogę siatkówkowo-tektalną), jak i z wczesnej kory wzrokowej (Fries, 1984), poprzez ramię SC.
Ponieważ efekty sumowania neuronów zostały wykazane u pacjentów neurologicznych pozbawionych kory wzrokowej, sygnały wzrokowe sumowane w obojczyku mogą być przekazywane bezpośrednio z siatkówki do powierzchownych warstw obojczyka poprzez drogę siatkówkowo-tektalną. Jeśli tak jest, to neuronalna sumacja może być zniesiona przez uszkodzenia ramienia SC.
Leki, które zakłócają ramię SC są bardzo rzadkie. Tutaj opisujemy pojedyncze przypadki dwóch pacjentów z jednostronnymi uszkodzeniami podkorowymi, które deafferentowały SC od wejścia wzrokowego, a które nie manifestowały RTE. U jednego pacjenta uszkodzenie uszkodziło zarówno jądro płucne wzgórza, jak i rostralną SC oraz jej ramię. U drugiego pacjenta, z uszkodzeniem grzbietowego śródmózgowia w wyniku urazowego uszkodzenia mózgu, SC wydawał się być nienaruszony, ale jego ramię było zaburzone.
Materiały i Metody
Uczestnicy
Dwóch pacjentów neurologicznych, każdy z własną, dopasowaną wiekowo grupą kontrolną, było badanych w eksperymencie mającym na celu pomiar RTE.
RE miał 71 lat w czasie badania. Wylew krwi do tylnego wzgórza 3 lata wcześniej zniszczył przyśrodkowy pulwinar, brzuszno-boczne jądra wzgórza i tylną kończynę torebki wewnętrznej z uszkodzeniem rozciągającym się na grzbietowy śródmózgowie, włączając pretectum i rostral SC (Rysunek 1). Probabilistyczna traktografia DTI (Behrens i in., 2003, Behrens i in., 2007) potwierdziła, że uszkodzenie zniszczyło ramię SC (Rysunek 2). RE była sparaliżowana po lewej stronie ciała z utratą czucia w lewej części twarzy i ramienia. Miała nieprawidłowe ruchy gałek ocznych, w tym retrakcję powiek, sparaliżowane pionowe ruchy gałek ocznych i upośledzoną konwergencję, które były konsekwencją rozszerzenia zmiany do grzbietowego śródmózgowia.
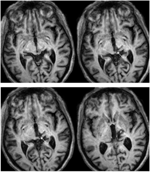
RYSUNEK 1. Wysokiej rozdzielczości (0,7 mm3) T1-ważony MRI pacjenta RE. Axial slices from ventral (Top left) to dorsal (Bottom right) showing the lesion in the right dorsal midbrain and thalamus. Rozszerzenie zmiany w rostralnym górnym móżdżku (SC) pokazane białymi strzałkami.
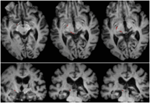
FIGURE 2. Traktografia uwidaczniająca trakt siatkówkowo-wektorowy u pacjenta RE współrejestrowana z T1-ważonymi plasterkami osiowymi (góra od brzusznego do grzbietowego) i koronalnymi (dół od przedniego do tylnego). Przebieg szlaku siatkówki jest widoczny w lewej półkuli (czerwony). W prawej półkuli nie prześledzono linii prądu, a przez porównanie z półkulą nienaruszoną widać, że uszkodzenie zniszczyło ramię SC w prawej półkuli. Strumień zaznaczony na czerwono został wygenerowany za pomocą traktografii probabilistycznej przy użyciu FSL FDT (FMRIB Diffusion Toolbox; Behrens i in., 2003, Behrens i in., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). Obrazy echo-planarnego rezonansu magnetycznego ważonego dyfuzją uzyskano w rozdzielczości 1,5 mm3 z 32 izotropowo rozmieszczonymi kierunkami kodującymi dyfuzję (b = 800) i linią podstawową (b = 0). Czas powtórzenia = 2 s, a czas echa = 35 ms. Do traktografii probabilistycznej, ręcznie zaznaczaliśmy region początkowy (tj. rysowaliśmy maski zalążkowe) na drodze wzrokowej każdej półkuli tuż za skrzyżowaniem i region docelowy (maska docelowa) na SC.
ML miała 23 lata w czasie badania. 7 lat wcześniej doznała poważnego urazu mózgu w wypadku drogowym, w wyniku którego doszło do rozlanego uszkodzenia aksonalnego z krwotokiem do prawej części mózgu śródmózgowia i grzbietu. Szczegóły dotyczące historii choroby, badania neurologicznego i wyników badań neuroobrazowych zostały przedstawione przez (Poliva i in., 2015). Chociaż pozostawiono pewne upośledzenie ruchowe, w tym spastyczność i ataksję, pacjentka odzyskała samodzielność. Główną niepełnosprawnością była ciężka agnozja słuchowa, spowodowana uszkodzeniem dróg słuchowych pnia mózgu, w tym lewego obojczyka dolnego. Ostrość wzroku i pola widzenia były niezaburzone, nie stwierdzono zaniedbania wzrokowego ani ekstynkcji. Objawy okulomotoryczne dysfunkcji śródmózgowia obejmowały szarpnięcia falą makro-kwadratową i skurcz konwergencji przy pionowym patrzeniu (bardziej w dół niż w górę). Rezonans magnetyczny wysokiej rozdzielczości wykazał jamę torbielowatą w prawym putamen w miejscu poprzedniego krwotoku i małą zmianę periventricularną w prawej dolnej części pons, w regionie dolnego szypuły móżdżku (rysunek 3). U pacjentki doszło do prawie całkowitego wyrwania lewego podkolana dolnego, z oszczędzeniem jedynie jego najbardziej przyśrodkowej i ogonowej części. Uszkodzenie rozszerzyło się na boczne pretectum i śródmózgowie tegmentum, niszcząc brachia górnego i dolnego obojczyka, oraz brzusznie na jądro czerwienne. Traktografia probabilistyczna DTI potwierdziła, że zmiana zniszczyła ramię SC (Rysunek 4).
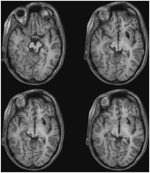
RYSUNEK 3. Wysokiej rozdzielczości (0,7 mm3) T1-ważony MRI pacjenta ML. Axial slices from ventral (Top left) to dorsal (Bottom right) showing damage to the left inferior colliculus and mesencephalic tegmentum ventral and lateral to the SC.
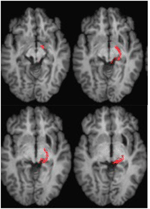
FIGURE 4. Traktografia DTI u pacjenta ML przedstawiająca trakt siatkówkowo-tektoniczny w prawej półkuli (kolor czerwony) współrejestrowany z obrazami T1-zależnymi MR w płaszczyźnie osiowej od brzusznej (góra po lewej) do grzbietowej (dół po prawej). Obrazy echo-planarnego rezonansu magnetycznego ważonego dyfuzją uzyskano w rozdzielczości 2 mm3 z 63 izotropowo rozmieszczonymi kierunkami kodowania dyfuzji (b = 1000) i linią podstawową (b = 0). Czas powtórzenia = 2 s, a czas echa = 35 ms. Traktografię wykonano zgodnie z opisem na rycinie 2.
Neurologicznie zdrowy obiekt kontrolny dla pacjenta RE obejmował 11 starszych dorosłych (sześć kobiet i pięciu mężczyzn, średni wiek: 68,5, zakres 59-73). Zostali oni zrekrutowani z panelu uczestników społeczności Uniwersytetu w Bangor. Uczestnicy nie mieli znanych neurologicznych, psychologicznych, psychiatrycznych lub poznawczych upośledzeń, a wszyscy uczestnicy mieli normalny / skorygowany do normalnego wzrok. Uczestnicy otrzymali zapłatę w wysokości 6 funtów za udział.
Zdrowe neurologicznie obiekty kontrolne dla pacjenta ML obejmowały 11 studentów i doktorantów Bangor University w wieku od 18 do 26 lat (siedem kobiet i czterech mężczyzn).
Przyrządy i warunki oglądania
Programowanie Presentation® działające na komputerze PC rejestrowało reakcje czasu reakcji (RT) i generowało bodźce, które były prezentowane na monitorze Dell (12,5″ × 25″, częstotliwość odświeżania 60 Hz) umieszczonym na poziomie oczu 57 cm przed uczestnikami z widzeniem dwuocznym w warunkach przyćmionego światła. Do zapewnienia stabilności głowy użyto podbródka i zagłówka. Odpowiedzi uczestników były rejestrowane poprzez naciśnięcie klawisza spacji na klawiaturze.
Bodźce
Bodźce eksperymentalne składały się z niewypełnionych białych kwadratów markera (1 cm × 1 cm) umieszczonych 8° na lewo i prawo od małego pola fiksacji (0,2 cm × 0,2 cm) na środku ekranu. Bodźce docelowe polegały na wypełnieniu jednego lub obu peryferyjnych pól znacznikowych tak, aby powstał pełny biały kwadrat. Wszystkie bodźce były białe, prezentowane na szarym tle.
Rys. 5 przedstawia sekwencję pojedynczej próby. Pola z markerami pozostawały widoczne przez cały czas trwania eksperymentu. Po przerwie między próbami wynoszącej 1750 ms, pojawiało się pole fiksacyjne, aby rozpocząć próbę. Po losowym odstępie czasu od 250 do 750 ms (co 25 ms), w miejscu jednego lub obu pól znacznikowych pojawiał się cel wymagający prostej reakcji na naciśnięcie klawisza spacji na klawiaturze. Celem był wypełniony biały kwadrat wygenerowany przez wypełnienie jednego lub obu pól znaczników. Losowo i z równym prawdopodobieństwem cele pojawiały się po lewej, prawej lub obu stronach jednocześnie. Żaden cel nie pojawił się w próbach catch (10% prób).
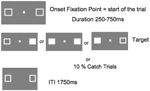
RYSUNEK 5. Sekwencja wyświetlania pojedynczej próby (ITI, inter-trial interval between participant response an onset of fixation point starting the next trial).
Procedura
Każdy uczestnik był badany w pojedynczej sesji. Po przeczytaniu instrukcji na ekranie, uczestnikom pokazywano przykłady wszystkich bodźców, które były prezentowane w zadaniu (pole fiksacji i każdą z trzech prezentacji celu) i proszono o potwierdzenie rozpoznania każdego celu poprzez naciśnięcie klawisza spacji. Instrukcja nakazywała utrzymanie fiksacji na centralnym polu przez czas trwania każdej próby i jak najszybszą reakcję poprzez naciśnięcie prawą ręką klawisza spacji, gdy tylko cel się pojawi.
Po potwierdzeniu przez uczestnika ustnie i poprzez naciśnięcie klawisza, że wszystkie instrukcje zostały zrozumiane, rozpoczęto prezentację prób praktycznych (10 z każdego warunku prezentacji celu i 3 próby „catch” bez celu). Informacja zwrotna na ekranie była prezentowana podczas kończenia prób praktycznych i zawierała następujące stwierdzenia: (1) „Poprawnie”, (2) „Staraj się reagować szybciej!” oraz (3) „Reaguj tylko wtedy, gdy widzisz cel”. Gdy sesja treningowa została zakończona i zarówno uczestnik, jak i eksperymentator byli pewni, że instrukcje dotyczące zadania zostały prawidłowo zrozumiane, uczestnik był zapraszany do rozpoczęcia eksperymentu. Pierwsze 30 prób z każdego bloku eksperymentalnego zostało wyłączone jako próby treningowe. Każdy blok składał się w sumie z 233 prób: 70 prób w prawo, 70 w lewo, 70 w obie strony i 23 próby „złapania”. W połowie bloku robiono krótką przerwę. Pacjent ML i młodsze grupy kontrolne były badane w jednym bloku. Ze względu na zmienność związaną z wiekiem i stanem pacjentki RE, była ona badana w dwóch blokach w oddzielnych dniach; a jej dopasowani wiekowo uczestnicy kontroli byli również badani w dwóch sesjach jednego dnia.
Analizy
Dla każdej grupy kontrolnej obliczono medianę RT dla każdego uczestnika w każdym warunku (cel lewy, cel prawy, cele obustronne) po wykluczeniu prób następujących po próbach łapania i tych z RT wynoszącym <100 ms lub >800 ms. Wykonano test t dla sparowanych prób, aby potwierdzić, że nie było asymetrii dla odpowiedzi na prawe i lewe cele jednostronne, i obliczono średni RT dla celów jednostronnych. RTE obliczano przez odjęcie RT dla prób dwustronnych od RT dla prób jednostronnych. Test t dla sparowanej próby porównał próby jednostronne z dwustronnymi, aby ustalić, czy RTE był statystycznie wiarygodny.
Dla każdego pacjenta, po wykluczeniu prób następujących po próbach połowicznych i tych z RT wynoszącym <100 ms lub >800 ms, test t dla sparowanej próby porównał medianę RT dla celów jednostronnych kontralateralnych i ipsilateralnych. Jak podano poniżej, RT dla odpowiedzi na kontralateralne cele były dłuższe niż dla ipsilateralnych celów jednostronnych. Aby ustalić, czy obecność celu kontralateralnego spowodowała statystycznie wiarygodny RTE, testem t dla sparowanych prób porównano medianę RT dla prób dla celów dwustronnych z próbami dla celów jednostronnych ipsilateralnych.
Aby sprawdzić, czy RTE był wiarygodnie mniejszy dla każdego pacjenta niż dla ich odpowiedniej grupy kontrolnej, RTE został obliczony dla każdego uczestnika kontroli i obliczono górną i dolną granicę 95% przedziału ufności (CI). Wartość Z-score dla RTE każdego pacjenta została obliczona w odniesieniu do jego grupy kontrolnej i przetestowana pod kątem wiarygodności statystycznej za pomocą testu t Crawforda.
Wartości P dla sparowanych testów t zostały podane dla dwóch ogonów, a dla t Crawforda, dla jednego ogona.
Wyniki
Pacjenci RE
Uczestnicy kontroli: Mean of the median RTs did not differ for left and right responses (t = 0.6.) Figure 6 shows that RTs were shorter (the RTE) for bilateral targets than for either left (t = 6.8, p < 0.001, or right (t1,10) = 3.8, p = 0.003) unilateral targets. Mediana RT dla prób z celami dwustronnymi została odjęta od średniej mediany RT dla celów jednostronnych, aby obliczyć średni RTE dla każdego uczestnika grupy kontrolnej. Średnia RTE w grupie kontrolnej wynosiła 24,3 ms (SEM = 2,75).

RYSUNEK 6. Mediana RT u pacjenta RE i średnia mediana RT dla uczestników grupy kontrolnej dla celów pojawiających się w lewym polu widzenia („Lewe”), prawym polu widzenia („Prawe”) i jednocześnie w obu polach widzenia („Oba”). Słupki błędów dla uczestników grupy kontrolnej oznaczają błędy standardowe.
Mediana RT u pacjentów RE była dłuższa niż u osób z grupy kontrolnej (ryc. 6) i znajdowała się powyżej górnej granicy 95% CI średnich RT dla wszystkich trzech warunków (lewe = 457 ms; prawe = 449 ms; oba = 426 ms). RT do celów jednostronnych w polu kontralesyjnym (lewym) były dłuższe niż do celów jednostronnych w polu ipsilesyjnym (prawym) (t = 6.0, p < 0.001).
Co ważne, nie stwierdzono RTE: mediana RT dla celów dwustronnych (500 ms) nie była krótsza niż dla celów jednostronnych w ipsilesionalnym (prawym) polu widzenia (494 ms; t = 1,141), p = ns (ryc. 6). Tabela 1 (u góry) pokazuje, że RTE obliczony dla pacjentki RE był istotnie mniejszy niż RTE dla jej grupy kontrolnej.

TABELA 1. Redundant target effect dla pacjentki RE (góra) i ML (dół) oraz średnie RTE dla ich odpowiednich grup kontrolnych z 95% przedziałami ufności (CI), wartościami Z oraz testem t Crawforda porównującym każdą pacjentkę z jej odpowiednią grupą kontrolną.
Pacjentka ML
Uczestnicy kontroli: Średnie z median RT nie różniły się dla odpowiedzi na lewe i prawe cele (t = 0,86. Rycina 7 pokazuje, że RT były krótsze (RTE) dla celów dwustronnych niż dla lewych (t = 4,7, p = 0,001, lub prawych (t1,11) = 7,8, p < 0,001) celów jednostronnych.

RYSUNEK 7. Mediana RT dla Pacjenta ML oraz średnia median RT dla uczestników grupy kontrolnej dla celów pojawiających się w lewym polu widzenia, prawym polu widzenia oraz jednocześnie w obu polach widzenia. Słupki błędów dla uczestników grupy kontrolnej oznaczają błędy standardowe.
Mediana RT dla prób z celami dwustronnymi została odjęta od średniej mediany RT dla celów jednostronnych lewych i prawych, aby obliczyć RTE dla każdego uczestnika grupy kontrolnej.
Średni RTE dla grupy wynosił 33 ms (SEM = 6,65).
Mediana RT u pacjenta ML była dłuższa niż u osób z grupy kontrolnej (Rysunek 7) i była powyżej górnej granicy 95% CI średniego RT dla wszystkich trzech warunków (lewy = 322 ms; prawy = 307 ms; oba = 277 ms). RT dla celów jednostronnych w prawym (kontralesyjnym) polu były dłuższe niż dla celów jednostronnych w lewym (ipsilesyjnym) polu (t = 4,9, p = 0,001). Nie zaobserwowano RTE. RT dla celów dwustronnych (361 ms) nie były krótsze niż dla celów jednostronnych w ipsilesionalnym (lewym) polu widzenia (363 ms). Tabela 1 (dolna) pokazuje, że RTE obliczony dla pacjentki ML był znacząco mniejszy niż RTE dla jej grupy kontrolnej.
Dyskusja
Proste RT były mierzone do wykrywania pojedynczych celów w polu kontralesyjnym lub ipsilesyjnym, oraz celów dwustronnych, u dwóch pacjentów, u których ramię SC było uszkodzone w jednej półkuli. U jednej z pacjentek (młodej kobiety) uszkodzenie dotyczyło lewej półkuli i było spowodowane urazowym uszkodzeniem mózgu; podczas gdy uszkodzenie obejmowało obojczyk dolny i rozciągało się na śródmózgowie, uszkodzenie SC per se nie było widoczne w neuroobrazowaniu o wysokiej rozdzielczości. U drugiego pacjenta (starsza kobieta) uszkodzenie dotyczyło prawej półkuli i było spowodowane krwotokiem nadciśnieniowym, który spowodował również rozległe uszkodzenie płucnika przyśrodkowego i wzgórza bocznego oraz rozszerzył się na grzbietową część śródmózgowia, w tym rostralną SC. U obu pacjentów prosty RT na wykrycie celów wzrokowych w polu kontralateralnym był spowolniony w porównaniu z polem ipsilesionalnym. Żaden z pacjentów nie wykazywał efektu sumowania przestrzennego (RTE) w wykrywaniu celów, gdy bodźce były prezentowane w obu polach widzenia.
Te obserwacje rzucają światło na rolę SC w wykrywaniu celów i, bardziej szczegółowo, rolę wizualnych aferentów do SC. Posner i in. (1980) operacyjnie zdefiniowali detekcję jako zdolność do arbitralnej odpowiedzi na sygnał wizualny (np. proste naciśnięcie klawisza palcem, jak w obecnym eksperymencie). Postawili tezę, że wykrywanie wymaga alokacji uwagi w celu wybrania celu do przetwarzania w systemie o ograniczonej pojemności, który nadaje mu priorytet do działania.
Song i in. (2011) wykazali, że inaktywacja małpiego SC powoduje uderzające deficyty wyboru celu, które nie mogą być łatwo wyjaśnione jako proste upośledzenie percepcji wzrokowej lub wykonania motorycznego, i zasugerowali, że przyczynia się do bardziej ogólnej mapy priorytetów. W tym eksperymencie małpy były prezentowane z dwoma bodźcami w przeciwległych polach widzenia i musiały wskazać, za pomocą reakcji sięgania, który pojawił się jako pierwszy. Jedna z małp była trenowana do sięgania w kierunku bodźca, który pojawił się jako pierwszy, a druga do sięgania w kierunku celu, który pojawił się jako drugi. W obu przypadkach występowała silna tendencja do wybierania celu, który znajdował się w polu widzenia kontralateralnym do uszkodzenia. Ponieważ ta sama tendencja była obserwowana u małpy, która sięgała do drugiego celu, który się pojawił, tendencja ta nie mogła być przypisana opóźnieniu w postrzeganiu kontralateralnego celu. Inaktywacja kolczystokomórkowa nie spowodowała upośledzenia percepcyjnej oceny, który bodziec pojawił się jako pierwszy. Raczej, bodźce w polu widzenia kontralateralnego do nieaktywnego obojczyka były upośledzone w priorytetyzacji do działania.
Zhaoping (2016) ostatnio podkreśliła rozróżnienie pomiędzy neuronowymi mapami saliencji i mapami priorytetu i argumentowała za ewolucyjną migracją percepcyjnej mapy saliencji z tarczy nerwu wzrokowego/SC do pierwotnej kory wzrokowej. Zaproponowała, że sygnały saliencji mogą być przekazywane do mapy priorytetowej w SC bez projekcji właściwości dostrajania cech.
Szkielet ramienny SC przekazuje aferentne sygnały wzrokowe do powierzchownych warstw okrężnicy z siatkówki poprzez trakt siatkówkowo-tektalny; ale większość wizualnych włókien aferentnych przekazywanych przez szkielet ramienny to projekcje z pierwotnej kory wzrokowej. Jeśli ramię jest uszkodzone, sygnały wrażliwości z pierwszorzędowej kory wzrokowej mogą być przekazywane do obojczyka przez przednie pola oczu. Jednak w przypadku braku bezpośrednich projekcji do powierzchownych warstw obojczyka z siatkówki lub kory wzrokowej, jak przypuszczamy u pacjentów z uszkodzeniem kości ramiennej, aktywacja mapy priorytetów obojczyka trwa dłużej, co skutkuje wolniejszymi reakcjami na kontralesyjne sygnały wzrokowe.
Jak zauważono we wstępie, wkład do RTE, który jest oparty na probabilistycznym modelu konia wyścigowego jest zależny od wykrycia obu celów; i od wyścigu, w którym wydajność niezależnych kanałów, w których dwa cele są transmitowane są równoważne, tak, że wynik wyścigu do osiągnięcia progu wykrycia jest losowy od próby do próby. Ponieważ próg detekcji dla sygnałów kontralesyjnych jest wyższy u pacjentów opisanych tutaj, nadmiarowe cele nie mogły odnieść korzyści w oparciu o stochastyczny wyścig konny; to znaczy, wynik wyścigu między sygnałami ipsilesionalnymi i kontralesyjnymi nie jest losowy – sygnały kontralesyjne są bardziej prawdopodobne, aby przegrać wyścig niż go wygrać.
Niemniej jednak, badania u pacjentów z hemianopią wykazały, że istnieje również neuronalna składowa sumacyjna, która przyczynia się do RTE, która nie zależy od detekcji obu celów (Marzi i in., 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Ponieważ wykazano, że u pacjentów po commissurotomii występuje RTE (Marzi i in., 1986; Reuter-Lorenz i in., 1995), argumentowano, że międzypółkulowa integracja sygnałów na południku pionowym musi zachodzić podkorowo.
Savazzi i Marzi (2004) wykazali, że sumowanie neuronalne nie występuje w przypadku chromatycznych bodźców docelowych o krótkiej długości fali u osób neurologicznie nieuszkodzonych lub u pacjentów z rozdwojeniem mózgu. Leh i wsp. (2006b) donoszą, że podczas gdy RTE wystąpiła z achromatycznymi bodźcami u niektórych pacjentów z hemianopią półkulową, nie było u nich RTE, gdy jako cele używano bodźców chromatycznych o krótkiej długości fali. Bodźce o krótkiej długości fali (np. fioletowe) aktywują tylko stożki S w siatkówce. Komórki zwojowe siatkówki, które otrzymują wejście od stożków S, nie rzutują ani bezpośrednio do SC, ani do warstw magnokomórkowych jądra bocznego genikulusa (De Monasterio, 1978). Ponieważ projekcje z pierwotnej kory wzrokowej do SC przez ramię SC przekazują tylko sygnały wzrokowe z magnokomórkowych aferentów genikulostriaty (Schiller i in., 1979), niepowodzenie bodźców stożka S by wywołać RTE sugeruje, że neuronalna sumacja zachodzi w SC i jest zależna od wzrokowych aferentów przekazywanych przez jej ramię.
Istnieją więc zbieżne dowody u pacjentów z rozdwojeniem mózgu, pacjentów hemianopowych z niedowidzeniem i z eksperymentów używających bodźców o krótkiej długości fali, że neuronalna sumacja zachodzi w SC. Niemniej jednak, podczas gdy bodźce o krótkiej długości fali nie aktywują komórek zwojowych siatkówki, które rzutują do SC przez ramię, nie można wnioskować, że obojczyk jest całkowicie ślepy na takie bodźce. Nagrania pojedynczych jednostek w SC małp wykazały, że bodźce o krótkiej długości fali aktywują odpowiedzi w powierzchownych warstwach okrężnicy. Co więcej, traktografia wykazała, u tych pacjentów po hemispherectomii z RTE (tj. ślepowidzeniem), ale nie u tych, którzy nie wykazywali dowodów ślepowidzenia, że SC ma połączenie z nieuszkodzoną półkulą (Leh i in., 2006a).
Wyniki obecnego badania dostarczają zatem pierwszych bezpośrednich dowodów na to, że w SC zachodzi sumowanie przestrzenne zależne od transmisji sygnałów wzrokowych przez ramię.
Oświadczenie etyczne
Badanie przeprowadzono zgodnie z wytycznymi i po zatwierdzeniu protokołu przez NHS Ethics Committee, Bangor, UK, oraz School of Psychology Ethics Committee of Bangor University, UK. Ustna i pisemna świadoma zgoda została uzyskana od wszystkich uczestników zgodnie z Deklaracją Helsińską.
Wkład Autorów
MvK: Zmyślił badania, zaprojektował i zaprogramował eksperyment, zebrał i przeanalizował dane pacjentów oraz przyczynił się do napisania manuskryptu. KK: Zebrał dane kontrolne, przejrzał odpowiednią literaturę, przeanalizował dane kontrolne i przyczynił się do napisania manuskryptu. RR: Rekrutował pacjentów i analizował badania neuroobrazowe, w tym wirtualną dysekcję z traktografią DTI, przygotowywał historie przypadków pacjentów i przyczynił się do napisania manuskryptu.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Characterization and propagation of uncertainty in diffusion-weighted MR imaging. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., and Woolrich, M. W. (2007). Probabilistyczna traktografia dyfuzyjna z wieloma orientacjami włókien: co możemy zyskać? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). The superior colliculus is sensitive to gestalt-like stimulus configuration in hemispherectomy patients. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Czas reakcji jako miara facylitacji intersensorycznej. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., and Wurtz, R. (1983). Wizualne i okulomotoryczne funkcje małpiej substantia nigra pars reticulata. III. pamięci uwarunkowane wizualne i sakkady odpowiedzi. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., and Ptito, A. (2006a). Unconscious vision: new insights into the neuronal correlate of blindsight using diffusion tractography. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Funkcjonalne mapowanie ludzkiej kory słuchowej: badanie fMRI u pacjenta z agnozją słuchową spowodowaną urazem obojczyka dolnego. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.00000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., and Davidson, B. (1980). Uwaga i wykrywanie sygnałów. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Statystyczna facylitacja czasów reakcji prostych. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., and Hughes, H. C. (1995). Fate of neglected targets: a chronometric analysis of redundant target effects in the bisected brain. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., and Marzi, C. A. (2004). The superior colliculus subserves interhemispheric neural summation in both normals and patients with a total section or agenesis of the corpus callosum. Neuropsychologia 42, 1608-1618. doi: 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). Composition of geniculostriate input ot superior colliculus of the rhesus monkey. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., and Wurtz, R. (2000). Composition and topographic organization of signals sent from the frontal eye field to the superior colliculus. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar