Outcome of Fetuses With Abnormal Cavum Septi Pellucidi: Experience of a Tertiary Center
George Lucian Zorilaa, Stefania Tudorachea, Elena-Madalina Barbua, Maria-Cristina Comanescua, Razvan-Grigoras Capitanescua, Marius-Cristian Marinasb, Maria Floreaa, Nicolae Cerneaa, Dominic Gabriel Iliescua
aPrenatal Diagnosis Unit, Department of Obstetrics and Gynecology, University Emergency County Hospital, Craiova, Romania
bDepartment of Anatomy, University of Medicine and Pharmacy of Craiova, Romania
Corresponding Author: Stefania Tudorache, Prenatal Diagnosis Unit, Department of Obstetrics and Gynecology, University Emergency County Hospital, Craiova, Romania
Manuscript accepted for publication December 28, 2016
Short title: Fetuses With Abnormal Cavum Septi Pellucidi
doi: https://doi.org/10.14740/jcgo423w
- Abstract
- Introduction
- Methods
- Results
- Discussion
| Abstract | ▴Top |
Background: Cavum septi pellucidi (CSP) is easily evaluated in the second and third trimester of the pregnancy. Struktura ta jest ważną cechą standardowych płaszczyzn używanych do rutynowej oceny morfologicznej głowy płodu i ośrodkowego układu nerwowego (OUN): płaszczyzny trans-wzgórzowej i trans-komorowej. Standardowy opis CSP to bezechowe prostokątne pole pomiędzy dwoma hiperechogenicznymi liniami reprezentowanymi przez przegrodę międzykomorową (septum pellucidum). Aspekty patologiczne są reprezentowane głównie przez brak normalnego wyglądu, który jest związany z ciężkimi wadami rozwojowymi OUN w linii środkowej mózgu, takimi jak agenezja ciała modzelowatego, hydranencefalia, porencefalia, schizencefalia, holoprosencefalia, syntelencefalia lub ciężka przewlekła hydrocefalia. Inne problemy, takie jak zwiększone lub zmniejszone wymiary CSP, nie są uważane za istotne, jeśli występują pojedynczo, chociaż niektórzy autorzy sugerują przeprowadzenie badania genetycznego płodu. Celem pracy była ocena wyników płodów z nieprawidłowym CSP wykrytym za pomocą sonografii w ciągu ostatnich 5 lat na Oddziale Diagnostyki Prenatalnej (Prenatal Diagnosis Unit – PDU) w naszym ośrodku trzeciego wieku.
Metody: Przeprowadziliśmy retrospektywny przegląd przypadków z nieprawidłowym CSP ocenianych w naszym trzeciorzędowym oddziale, zdiagnozowanych w okresie od stycznia 2012 do listopada 2016 roku. Anatomia płodu była oceniana we wszystkich przypadkach zgodnie z zaleceniami międzynarodowych wytycznych. W nieprawidłowych przypadkach CSP wykonywano neurosonogram płodowy i rozszerzony skan anomalii płodu oraz proponowano amniopunkcję w celu identyfikacji zaburzeń genetycznych.
Wyniki: Łącznie przebadano morfologicznie 7520 przypadków, a nieprawidłowy CSP stwierdzono w 36 przypadkach. Brak CSP był wstępną obserwacją, która zainicjowała dalsze badania i diagnostykę w przypadkach z agenezją ciała modzelowatego (ACC) (7 przypadków) i dysplazją septo-optyczną (2 przypadki). W hydranencefalii lub ciężkiej hydrocefalii, porencefalii, schizencefalii i holoprosencefalii, silnie zniekształcony aspekt mózgu jest oczywisty, a brak CSP jest tylko obserwacją, o mniejszym znaczeniu diagnostycznym i implikacjach klinicznych. Częściowy lub całkowity ACC był głównie związany z nieobecnym CSP, ponieważ rozwój dwóch struktur jest połączony. Prawie połowa wszystkich nieprawidłowych przypadków CSP (16/36) była związana z zaburzeniami genetycznymi, w większości z nieprawidłowym kariotypem i wszystkie były związane z brakiem CSP. Utrzymujące się powiększenie CSP (4/36 przypadków) i hiperechogeniczny aspekt CSP (1/36) nie były związane z innymi strukturalnymi lub genetycznymi nieprawidłowościami, a postnatalny rozwój neuromotoryczny był prawidłowy.
Wnioski: Ocena CSP jest obowiązkowa, a prawidłowe aspekty sugerują prawidłowy rozwój śródmózgowia. Ze względu na wysoką częstość występowania zaburzeń chromosomalnych, badania genetyczne powinny być proponowane szczególnie w przypadkach, w których nie występuje CSP. Ponieważ brak CSP wiąże się z poważnymi zaburzeniami strukturalnymi lub genetycznymi, jego wizualizacja w drugiej połowie ciąży jest obowiązkowa w każdym badaniu anomalii. Powiększenie i zmiany echogeniczności CSP wiążą się z korzystnym wynikiem noworodkowym. Zalecana jest jednak długotrwała obserwacja noworodków i niemowląt, które wydają się być w normie, ponieważ mogą one ostatnio rozwijać nieprawidłowe zachowania psychologiczne.
Słowa kluczowe: Cavum septi pellucidi; Corpus callosum; Badanie ultrasonograficzne; Neurosonogram; Diagnostyka prenatalna; Ośrodkowy układ nerwowy
| Wprowadzenie | ▴Top |
Cavum septi pellucidi (CSP) jest ważną strukturą, rozwija się razem z ciałem modzelowatym (CC) począwszy od 10 tygodnia życia płodowego (GA) do 18 tygodnia GA. Znajduje się ona w środkowej części mózgowia, powyżej rogu przepony, pomiędzy dwiema przyśrodkowymi ścianami komór bocznych i poniżej CC. Struktura ta jest kontynuowana ku tyłowi przez cavum vergae, a granicę między nimi stanowi płaszczyzna między foramenami Monroe. Większość autorów używa terminu CSP dla „CSP and Vergae”. My stosujemy się do tego terminu i używamy „CSP” dla obu struktur. Septi pellucidi służy jako ważna stacja przekaźnikowa; jego najważniejsze anatomiczne i funkcjonalne połączenia włókien są z hipokampem i podwzgórzem.
CSP jest rutynowo obrazowany po 18 tygodniach ciąży w trzech obowiązkowych widokach głowy płodu uzyskanych podczas sonografii płodu. W szczególności, oprócz obrazów komór i tylnego dołu czaszki, widok osiowy na poziomie sparowanych talemów daje zarówno średnicę dwuciemieniową, jak i CSP . Ważną kwestią w diagnostyce nieprawidłowego CSP jest to, aby nie pomylić fornix z CSP, ze względu na ich bliskość i względnie podobny wygląd. Prawidłowe CSP powinno być widoczne jako ciemne pole spowodowane płynem w jamie, otoczone dwiema białymi liniami po obu bocznych stronach, reprezentowanymi przez septum pellucidum. Na poziomie fornixu pole to jest przedzielone trzecią linią strzałkową. Różnicowanie to ma duże znaczenie, ponieważ rozwój fornix nie jest związany z CC .
Nieprawidłowe aspekty CSP obejmują jego brak, powiększenie lub echogeniczność. Normalne poszerzenie CSP zostało znormalizowane pomiędzy 2 a 4,7 mm (± 2 SD) w 19 – 20 tygodniu GA i do 9 mm jako górna granica w 38 tygodniu, biorąc pod uwagę również 2 SD . Powiększenie CSP było związane z hydrocefalią, translokacjami chromosomalnymi i ograniczeniem wzrostu. W przypadku stwierdzenia CSP jako izolowanej anomalii sonograficznej, wyniki płodowe są korzystne, chociaż należy zaproponować ocenę genetyczną płodu. Normalną ewolucją CSP po urodzeniu jest zamknięcie od cavum vergae do CSP, a tylko 15% tej przestrzeni jest widoczne w 6 miesiącu po urodzeniu. Powiększona CSP o ponad 1 cm po urodzeniu i utrzymywanie się CSP po okresie niemowlęcym zostały opisane jako „subtelne markery dysgenezy mózgowej”, prawdopodobnie związane z zaburzeniami neuropsychiatrycznymi, szczególnie schizofrenią. Dlatego ważna jest obserwacja poporodowa przypadków z prenatalnym powiększeniem CSP.
Brak CSP w drugim i trzecim trymestrze wiąże się z ACC, dysplazją septo-optyczną, hydranencefalią, porencefalią, schizencefalią, holoprosencefalią, syntelencefalią lub ciężką przewlekłą hydrocefalią.
W populacji prenatalnej duże badania dotyczące morfologiczno-genetycznych asocjacji nieprawidłowych CSP i ich częstości są przydatne w prenatalnym poradnictwie rodzicielskim. Biorąc pod uwagę niską częstość występowania anomalii i jej heterogenność, potrzebna jest duża liczba przypadków. Nasza seria jest jedną z największych w literaturze, a spektrum naszych danych daje możliwość włączenia ich do większej metaanalizy. Naszym celem było przedstawienie wyników leczenia przypadków z jakimikolwiek nieprawidłowymi aspektami CSP, które nie spełniają kryteriów normalności, np. nieprawidłowa echogeniczność.
| Metody | ▴Top |
Charakterystykę prenatalną przeanalizowano retrospektywnie na podstawie bazy danych USG, w okresie 5 lat, między styczniem 2012 a listopadem 2016 roku. Przypadki były badane w ośrodku trzeciorzędowym – Prenatal Diagnosis Unit (PDU) of the University Emergency County Hospital, Craiova, Romania. Anatomia płodu została oceniona we wszystkich przypadkach zgodnie z zaleceniami międzynarodowych wytycznych. Badania były wykonywane przez położników o specjalnym zainteresowaniu medycyną płodową, z minimum 2-letnim doświadczeniem w wykonywaniu USG prenatalnego. Przypadki z podejrzeniem nieprawidłowości, które nie mogły być potwierdzone podczas badania wstępnego, były zapraszane do ponownej oceny. W przypadku podejrzenia nieprawidłowości podczas badania USG, dwóch doświadczonych badaczy badało płód w celu potwierdzenia anomalii. W nieprawidłowych przypadkach CSP wykonywano neurosonogram płodu i rozszerzony skan anomalii płodu oraz proponowano amniopunkcję w celu identyfikacji zaburzeń genetycznych. We wszystkich przypadkach z nieprawidłowościami w OUN wykonano badanie ultrasonograficzne płodu 2D i 3D (aparat Voluson 730 Pro USG, GE Medical Systems). Post-processing uzyskanych woluminów miał na celu lepszą wizualizację nieprawidłowości lub związanych z nimi cech. Po uzyskaniu potwierdzenia, zespół interdyscyplinarny (położnik, genetyk, neonatolog – pediatra, chirurg dziecięcy) udzielał odpowiedniego poradnictwa i postępowania.
| Wyniki | ▴Top |
W przedziale czasowym, przebadaliśmy 7 520 ciąż pod kątem morfologicznym, wady rozwojowe OUN stwierdzono w 257 przypadkach, a główną anomalią była ventriculomegalia (ryc. 1). Nieprawidłowe CSP stwierdzono w 36 przypadkach w następujący sposób: brak CSP stwierdzono w 31 przypadkach (86,1% z anomalii CSP), powiększone CSP stwierdzono w 4 przypadkach (11.1%) i hiperechogeniczny CSP odnotowano w jednym przypadku (2,7%).
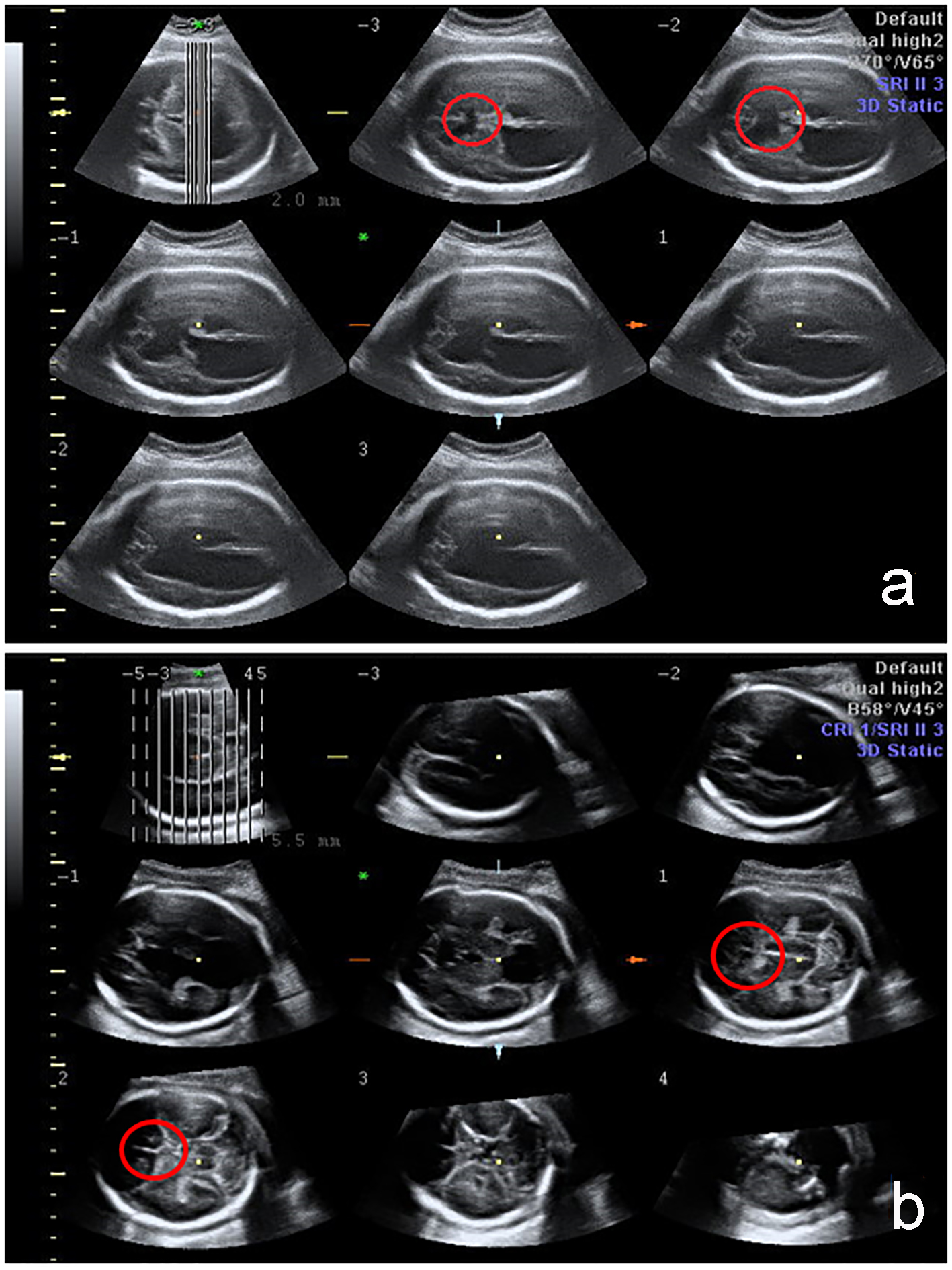 Kliknij, aby zobaczyć duży obraz |
Rycena 1. Ocena 3D OUN płodu za pomocą tomograficznego obrazowania ultrasonograficznego (TUI). Brak CSP jest zaznaczony czerwonym kółkiem w przypadkach z ciężkimi anomaliami mózgu: holoprosencefalią i schizencefalią. |
Nieprawidłowości OUN (ryc. 2) związane z brakiem CSP były następujące: agenezja ciała modzelowatego w siedmiu przypadkach (22,5%), holoprosencefalia (HPE) w trzech przypadkach (9.6%), syntelencefalia w dwóch przypadkach (6,4%), porencefalia w dwóch przypadkach (6,4%), masywna hydrocefalia w pięciu przypadkach (16,1%), anencefalia w czterech przypadkach (12,9%), schizencefalia w dwóch przypadkach (6,4%), encefalocele w jednym przypadku (3,2%) i dysplazja septo-optyczna w trzech przypadkach (9,6%). Malformacja Dandy-Walkera była związana z ACC w trzech z siedmiu przypadków.
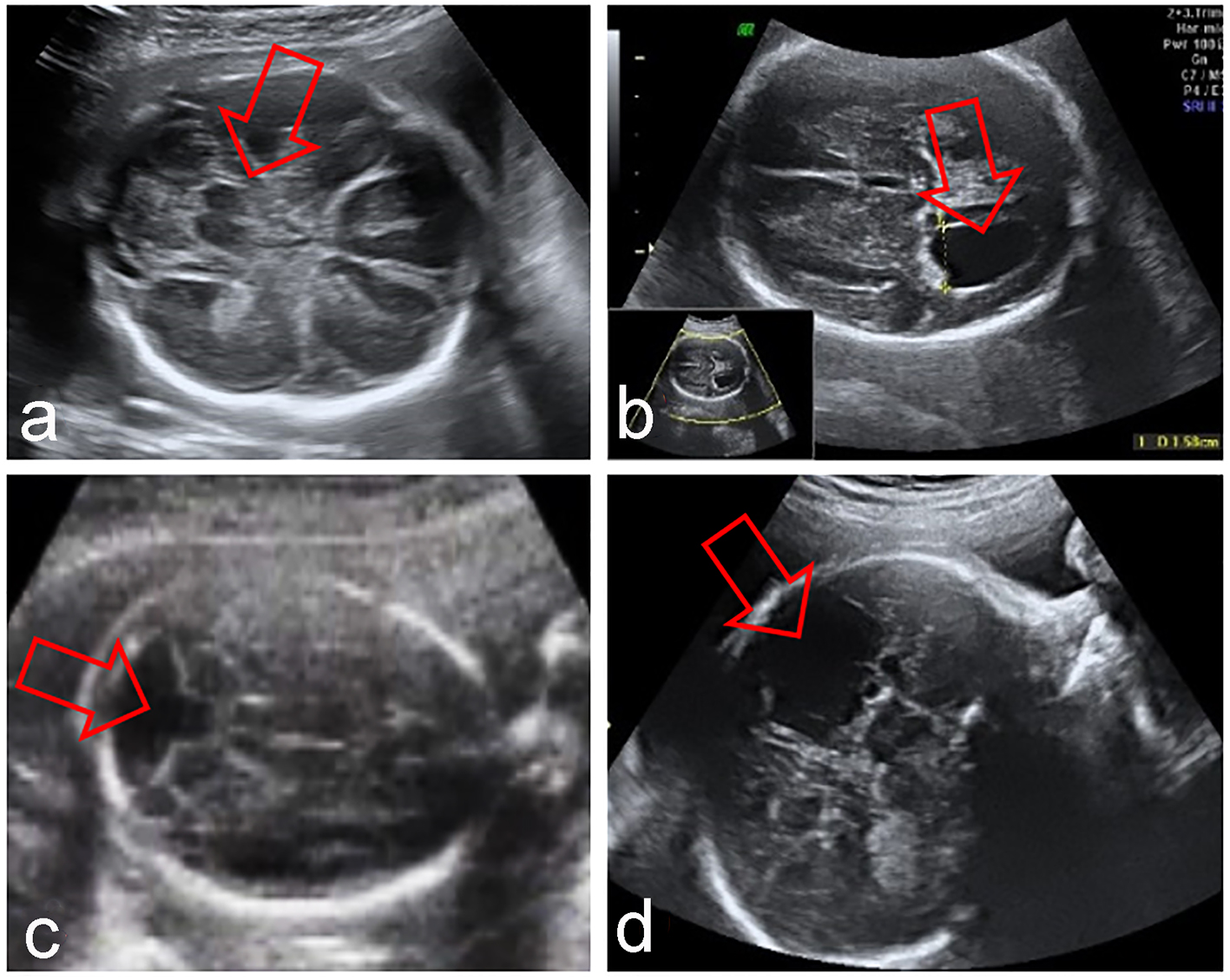 Kliknij, aby powiększyć obraz |
Rycena 2. Nieprawidłowości OUN płodu związane z nieobecnym CSP: syntelencefalia (a), hydrocefalia (b), zespół Dandy-Walkera (c), porencefalia (d). |
W dwóch przypadkach CSP był nieobecny w ciążach po 37 GW (6.4%), przy ich przyjęciu do naszego oddziału, jako pierwsza przedporodowa ocena obrazowa.
Jeden przypadek hiperechogenicznego CSP uznaliśmy za „nieprawidłowy”, ponieważ nie spełnia on kryteriów normalnego CSP: „czarna skrzynka pomiędzy dwoma białymi liniami”. Utrzymujące się powiększenie CSP (ryc. 3), jeśli przyjąć dwa odchylenia standardowe jako granicę odcięcia, stwierdzono w czterech przypadkach. Wszystkie te osoby nie miały innych anomalii strukturalnych, a badania genetyczne dały prawidłowe wyniki.
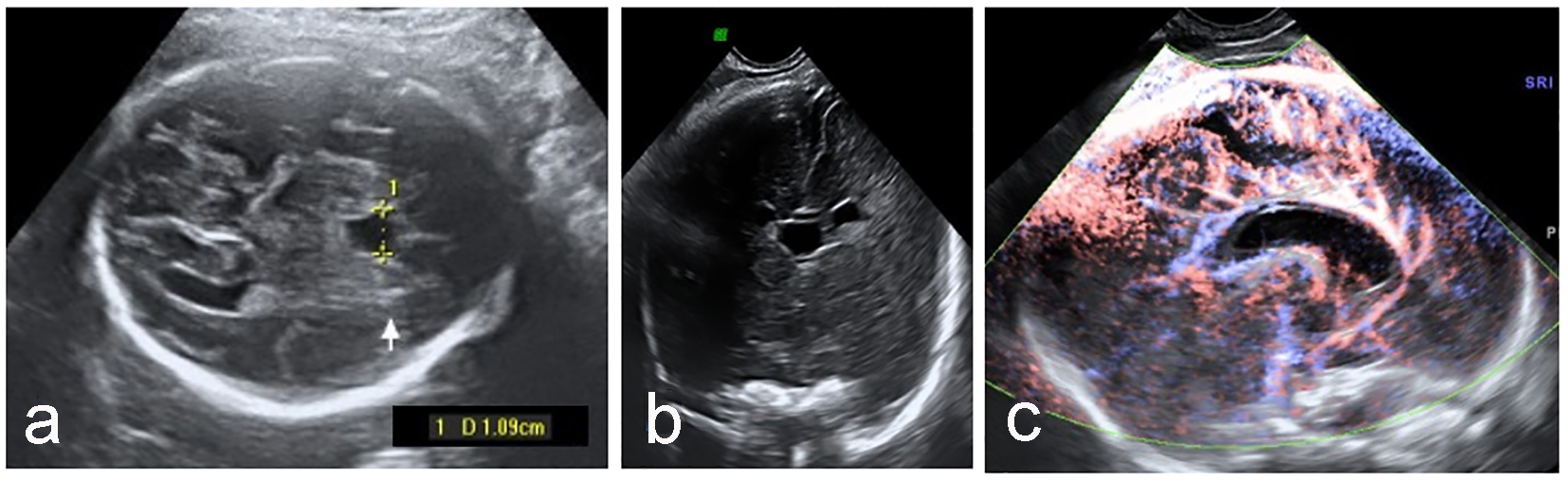 Kliknij, aby zobaczyć duży obraz |
Rysunek 3. Powiększony CSP (a) z prawidłowym przednim kompleksem mózgowym w płaszczyźnie koronowej (b) i tętnicą okołokomorową (c). |
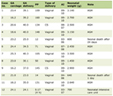
Badania genetyczne były dostępne w 24 przypadkach nieprawidłowego CSP, a zaburzenia stwierdzono w 16 przypadkach, wszystkie związane z nieobecnym CSP (Tabela 1). Genetic disorders were found in 16 cases, half of the cases with absence of CSP. Most frequent genetic disorders were trisomies (21,18,13), but we also found other chromosomal alteration, deletions and translocations.
 Click to view |
Table 1. Spectrum of CNS Abnormalities and the Associated Abnormalities |
| Discussion | ▴Top |
A normal CSP suggests a normal development of the prozencephalon and may rule out some commonly found CNS structural anomalies. Trzy badania ultrasonograficzne, obejmujące łącznie 1024 prawidłowych płodów, w drugim i trzecim trymestrze, wykazały, że CSP można uwidocznić i zmierzyć u 100% prawidłowych płodów między 20 a 37 tygodniem ciąży .
Zamknięcie CSP rozpoczyna się od tylnego cavum vaergae do przedniej rzeczywistej przestrzeni CSP. Stwierdzono, że cavum jest obecne w terminie w 85% przypadków i w 15% w 6 miesięcy po urodzeniu. Stwierdziliśmy dwa przypadki braku CSP w badaniach ultrasonograficznych wykonanych po 37 tygodniu. Przypadki te nie wykazywały towarzyszących anomalii. Ich prezentacja do badania ultrasonograficznego płodu była pierwszą w obecnej ciąży.
Rozwój CSP jest silnie związany z ciałem modzelowatym, a większość autorów uznała, że prawidłowe CSP równa się prawidłowemu CC. Chociaż brak uwidocznienia CSP nie jest synonimem agenezji ciała modzelowatego, te dwie jednostki są często kojarzone. Ponieważ ciało modzelowate nie jest rutynowo uwidaczniane podczas podstawowej oceny OUN w badaniu anomalii płodu, identyfikacja prawidłowego wyglądu CSP ma duże znaczenie w wykrywaniu ACC. Mimo to CSP może nie być uwidocznione pomimo prawidłowego CC. Ponieważ brak CSP jest najczęściej związany z ACC, w takich przypadkach pierwszym krokiem jest ocena rozwoju CC w projekcji osiowej, koronalnej i strzałkowej oraz uwidocznienie tętnicy okołokorzeniowej za pomocą badania dopplerowskiego w płaszczyźnie strzałkowej. MRI i traktografia są przydatne do potwierdzenia aspektów ultrasonograficznych. W naszym badaniu, brak CSP był związany z ACC w siedmiu przypadkach (dwa przypadki jako częściowa i pięć jako całkowita agenezja). W czterech z tych przypadków (57%) opisano pozamózgowe anomalie strukturalne, a inne anomalie OUN stwierdzono w około 42% wszystkich przypadków. W dwóch z siedmiu przypadków stwierdziliśmy zespół Dandy’ego-Walkera – większość autorów opisywała około jednej trzeciej przypadków, a w jednym przypadku obecne było rozszczepienie kręgosłupa.
Kolejną istotną nieprawidłowością, która odnosi korzyści z wizualizacji CSP, jest dysplazja septo-optyczna. W tym schorzeniu jedynym nieprawidłowym objawem w prenatalnym badaniu ultrasonograficznym może być brak CSP, dlatego rutynowa ocena CSP jest bardzo ważna w wykrywaniu tych przypadków, chociaż MRI ma kluczowe znaczenie dla potwierdzenia rozpoznania. W dwóch przypadkach zespołu Morsiera (dysplazja septo-optyczna) brak CSP połączono z prawidłowym CC. CSP był nieobecny i występowała niewielka komunikacja między rogami przednimi komór bocznych, podczas gdy CC był normalnie rozwinięty. Stan ten potwierdzono po porodzie, a w jednym z tych przypadków stwierdzono jednostronny rozszczep warg. W drugim przypadku stwierdzono obecność prawego łuku aorty z lewym przewodem tętniczym.
Dostępnych było 24/36 badań genetycznych (próbki cytogenetyczne i molekularne). Zaburzenia stwierdzono w 16 nieprawidłowych przypadkach CSP, z czego w 13 przypadkach był to nieprawidłowy kariotyp, a w pozostałych trzech nieprawidłowy wynik badania molekularnego CGH. Ocena genetyczna jest obowiązkowa, szczególnie w przypadku braku CSP, kariotyp i mikromacierz są również wysoce zalecane.
Absentny CSP może być związany z dużą liczbą zaburzeń strukturalnych, takich jak holoprosencefalia (HPE), od alobar do lobar, oraz ostatnio opisana jednostka syntelencefalii; dysplazja septo-optyczna (SOD); dysgenezja i hipogeneza ciała modzelowatego; przewlekłe, ciężkie wodogłowie, zwykle spowodowane zwężeniem przewodu wodnego lub malformacją Chiari II; schizencefalia; porencefalia, hydranencefalia; encefalole podstawne; izolowany brak przegrody. W hydranencefalii, porencefalii, schizencefalii, holoprosencefalii i ciężkiej wodogłowiu, silnie zniekształcony aspekt mózgu jest oczywisty, a nieprawidłowość CSP jest tylko obserwacją, ale o mniejszym znaczeniu diagnostycznym i prognostycznym w tych przypadkach.
Nieznane jest rzeczywiste znaczenie kliniczne powiększonego prenatalnego CSP, ale podkreśla się, że po takim stwierdzeniu powinno nastąpić szczegółowe poszukiwanie towarzyszących anomalii i wskazana jest postnatalna ocena obrazowa i rozwojowa. Utrzymywanie się szerokiego CSP po urodzeniu było związane ze schizofrenią, jeśli jego szerokość przekracza 10 mm, dlatego w takich przypadkach wymagana jest ścisła obserwacja .
Hyperechogeniczny CSP nie był dotychczas opisywany w literaturze, dlatego ścisła obserwacja naszego odosobnionego przypadku jest dość istotna. Rozszerzone badania prenatalne, takie jak MRI i badania genetyczne, dały prawidłowe wyniki. The infant had a good progress in the first year.
Conclusions
Absent CSP is a very important CNS malformation marker, and its presence should trigger extended fetal morpho-genetic evaluation. In our experience, almost half of the cases associated genetic disorders and 39% associated structural malformations.
Other aspects as isolated enlargement or hyperechoic CSP need further evaluation in larger studies on a long-term outcome in order to establish their significance, as our cases presented a normal postpartum initial evolution, but the number of these abnormalities communicated in the literature is low.
| ▴Top |
- AIUM Practice Guideline for the performance of an antepartum obstetric ultrasound examination. J Ultrasound Med. 2003;22(10):1116-1125.
pubmed - AIUM practice guideline for the performance of obstetric ultrasound examinations. J Ultrasound Med. 2010;29(1):157-166.
pubmed - Filly RA, Cardoza JD, Goldstein RB, Barkovich AJ. Detection of fetal central nervous system anomalies: a practical level of effort for a routine sonogram. Radiology. 1989;172(2):403-408.
doi pubmed - Nyberg DA. Recommendations for obstetric sonography in the evaluation of the fetal cranium. Radiology. 1989;172(2):309-311.
doi pubmed - Gushiken BJ, Goldstein RB. Praktyczne podejście do oceny osi neuronalnej płodu. Semin Roentgenol. 1999;34(1):5-12.
doi - ACOG Practice Bulletin No. 58. Ultrasonografia w ciąży. Obstet Gynecol. 2004;104(6):1449-1458.
doi - Angtuaco TL. Ultrasound imaging of fetal brain abnormalities: three essential anatomical levels. Ultrasound Q. 2005;21(4):287-294.
doi pubmed - Badanie ultrasonograficzne ośrodkowego układu nerwowego płodu: wytyczne dotyczące wykonywania „badania podstawowego” i „neurosonogramu płodu”. Ultrasound Obstet Gynecol. 2007;29(1):109-116.
doi pubmed - Callen PW, Callen AL, Glenn OA, Toi A. Columns of the fornix, not to be confaken for the cavum septi pellucidi on prenatal sonography. J Ultrasound Med. 2008;27(1):25-31.
pubmed - Timor-Tritsch E. Ultrasonography of the prenatal brain, third edition. McGraw Hill, 2012; 2:62-65, 3:128, 6:235-244.
- Sherer DM, Sokolovski M, Dalloul M, Santoso P, Curcio J, Abulafia O. Prenatal diagnosis of dilated cavum septum pellucidum et vergae. Am J Perinatol. 2004;21(5):247-251.
doi pubmed - Bronshtein M, Weiner Z. Prenatal diagnosis of dilated cava septi pellucidi et vergae: associated anomalies, differential diagnosis, and pregnancy outcome. Obstet Gynecol. 1992;80(5):838-842.
pubmed - Jou HJ, Shyu MK, Wu SC, Chen SM, Su CH, Hsieh FJ. Ultrasound measurement of the fetal cavum septi pellucidi. Ultrasound Obstet Gynecol. 1998;12(6):419-421.
doi pubmed - Winter TC, Kennedy AM, Byrne J, Woodward PJ. The cavum septi pellucidi: dlaczego jest to ważne? J Ultrasound Med. 2010;29(3):427-444.
pubmed - Falco P, Gabrielli S, Visentin A, Perolo A, Pilu G, Bovicelli L. Transabdominal sonography of the cavum septum pellucidum in normal fetuses in the second and third trimesters of pregnancy. Ultrasound Obstet Gynecol. 2000;16(6):549-553.
doi pubmed - Serhatlioglu S, Kocakoc E, Kiris A, Sapmaz E, Boztosun Y, Bozgeyik Z. Sonographic measurement of the fetal cerebellum, cisterna magna, and cavum septum pellucidum in normal fetuses in the second and third trimesters of pregnancy. J Clin Ultrasound. 2003;31(4):194-200.
doi pubmed - Paladini D, Pastore G, Cavallaro A, Massaro M, Nappi C. Agenesis of the fetal corpus callosum: sonographic signs change with advancing gestational age. Ultrasound Obstet Gynecol. 2013;42(6):687-690.
doi pubmed - Mitter C, Prayer D, Brugger PC, Weber M, Kasprian G. In vivo tractography of fetal association fibers. PLoS One. 2015;10(3):e0119536.
doi pubmed - Sarwar M. The septum pellucidum: normal and abnormal. AJNR Am J Neuroradiol. 1989;10(5):989-1005.
pubmed
To jest artykuł typu open-access rozpowszechniany zgodnie z warunkami licencji Creative Commons Attribution-NonCommercial 4.0 International License, która zezwala na nieograniczone niekomercyjne użycie, dystrybucję i reprodukcję w dowolnym medium, pod warunkiem, że oryginalna praca jest odpowiednio cytowana.
Journal of Clinical Gynecology and Obstetrics jest publikowany przez Elmer Press Inc.
.