Naturalna ucieczka z genetycznego więzienia
Modyfikacje posttranslacyjne: Krótki przegląd
Jak działają modyfikacje posttranslacyjne?
Najczęściej spotykane modyfikacje posttranslacyjne
Wpływ modyfikacji posttranslacyjnych na zdrowie i choroby
Krótki przegląd
Co oznacza termin PTM?
Komórki muszą wykrywać i reagować na zmiany warunków wewnętrznych i zewnętrznych. Jedną z metod wykorzystywanych do dostosowania się do tych zmian jest chemiczna modyfikacja białek. Warunkowe zmiany chemiczne są przekazywane z czujników do efektorów poprzez odwracalne modyfikacje potranslacyjne (PTM) białek. PTM odgrywają ważną rolę w modyfikowaniu końcowego produktu ekspresji, przyczyniają się do procesów biologicznych i stanów chorobowych, odgrywając kluczową rolę w wielu procesach komórkowych, takich jak różnicowanie komórkowe (1), degradacja białek, sygnalizacja i procesy regulacyjne, regulacja ekspresji genów oraz interakcje białko-białko (2,3).
Jak działa modyfikacja posttranslacyjna?
PTM mogą zachodzić na każdym etapie życia białka. Wiele białek jest modyfikowanych wkrótce po zakończeniu translacji, aby ułatwić prawidłowe składanie lub skierować powstające białko do określonych miejsc w komórce (takich jak jądro czy błona). Inne modyfikacje zachodzą po zakończeniu procesu fałdowania i lokalizacji w celu aktywacji lub dezaktywacji aktywności katalitycznej. Białka są również kowalencyjnie połączone ze znacznikami, które kierują białko do degradacji. Są one modyfikowane poprzez połączenie potranslacyjnego rozszczepiania i dodawania grup funkcyjnych w ramach stopniowego mechanizmu dojrzewania lub aktywacji białek.
Gdzie występują modyfikacje potranslacyjne? PTM zachodzą w łańcuchach bocznych aminokwasów lub wiązaniach peptydowych i są najczęściej wywoływane przez aktywność enzymatyczną. Rzeczywiście, 5% proteomu zawiera enzymy, które wykonują ponad 200 rodzajów PTM (4). Enzymy te obejmują kinazy, fosfatazy, transferazy i ligazy, które dodają lub usuwają grupy funkcyjne, białka, lipidy lub cukry do lub z łańcuchów bocznych aminokwasów, oraz proteazy, które rozszczepiają wiązania peptydowe w celu usunięcia specyficznych sekwencji lub podjednostek regulatorowych. Wiele białek może również modyfikować się za pomocą domen autokatalitycznych, takich jak domeny autokinazowe i autoprotolityczne. PTM mogą być również odwracalne w zależności od charakteru modyfikacji. Na przykład fosfatazy hydrolizują grupę fosforanową, aby usunąć ją z białka i odwrócić jego aktywność biologiczną (Rysunek 1).
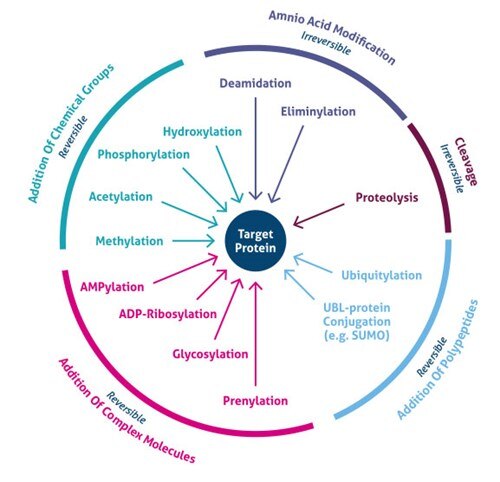
Figura 1. Rodzaje modyfikacji potranslacyjnych (PTMs).
Najczęstsze modyfikacje potranslacyjne
Ostatni rozwój metod spektrometrii mas (MS) umożliwił identyfikację tysięcy miejsc PTM. W konsekwencji, nowe strategie wzbogacania odkryły globalne znaczenie komórkowe kilku typów modyfikacji (np. acetylacja, ubikwitylacja, O-GlNac, N-liniowa glikozylacja). Obecnie znanych jest ponad 200 różnych typów PTM (5,6), począwszy od małych modyfikacji chemicznych (np. fosforylacja i acetylacja), aż po dodawanie całych białek (np. ubikwitylacja, Rycina 3).
Fosforylacja
Fosforylacja białek (Rycina 2) jest najczęściej badaną modyfikacją potranslacyjną. Szacuje się, że jedna trzecia białek ssaków może być fosforylowana, a modyfikacja ta często odgrywa kluczową rolę w modulowaniu funkcji białek. Fosforylacja zachodzi na resztach serynowych, treoninowych i tyrozynowych, regulując funkcję białek, aktywność enzymatyczną, interakcje białko-białko i lokalizację białek. Fosforylacja jest katalizowana przez fosfatazy i może być odwracalna – fosforylowane białka mogą być deposforylowane przez deposfatazy białkowe.
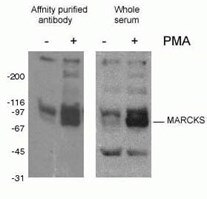
Rysunek 2. Wynik WB przeciwciała phospho-Marcks (10018-3-AP, 1:1500) z komórkami makrofagów mysich J774 poddanych działaniu PMA.
Glikozylacja i glikanacja
Większość białek, które są syntetyzowane na rybosomach związanych z retikulum endoplazmatycznym, ulega glikozylacji. Oznacza to, że do łańcucha polipeptydowego dodawane jest kowalencyjne przyłączenie cząsteczek cukru. Dwa najczęstsze typy glikozylacji u Eukariotów to glikozylacja N-linkowa – do asparaginy oraz O-linkowa – do seryny i treoniny.
Ubiquitynacja
Ubiquitynacja białka oznacza kowalencyjne dodanie ubikwityny do lizyny, cysteiny, seryny, treoniny lub bezpośrednio do N-końca białka. Ubikwityna jest małym (+/-8,6 kDa) białkiem występującym w prawie wszystkich typach tkanek (rys. 3). Ubikwitynacja jest reakcją enzymatyczną katalizowaną przez kaskadę trzech enzymów (E1, E2 i E3). Zapewnia to specyficzność substratu oraz etapy aktywacji, koniugacji i ligacji. Białka mogą być monoubikwitynowane (z jedną cząsteczką ubikwityny) lub polubikwitynowane. Polikwitynacja ma miejsce, gdy do początkowej cząsteczki ubikwityny dodawane są dodatkowe cząsteczki ubikwityny. Ubikwitynacja poprzez proteom może oznaczać białka do degradacji. Jest ona również ważna dla sygnalizacji komórkowej, internalizacji białek błonowych oraz rozwoju i regulacji transkrypcji.

Figura 3. Komórki MDA-MB-453s poddano SDS PAGE, po czym wykonano western blot z 10201-2-AP (przeciwciało ubikwityny) w rozcieńczeniu 1:600.
Wpływ PTM na zdrowie i choroby
Analiza białek i ich PTM jest szczególnie ważna w badaniu chorób serca, nowotworów, chorób neurodegeneracyjnych i cukrzycy (7). Głównym wyzwaniem w badaniu białek modyfikowanych potranslacyjnie jest opracowanie specyficznych metod detekcji i oczyszczania. Na szczęście, te techniczne przeszkody są pokonywane dzięki różnym nowym i udoskonalonym technologiom proteomicznym.
- Biologia chemiczna: ubrane białka.
- Koncepcje w sumoilacji: dekada dalej.
- Analiza proteomiczna w naukach neurobiologicznych.The Roles of Post-translational Modifications in the Context of Protein Interaction Networks
- Deciphering a global network of functionally associated post-translational modifications.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
