THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
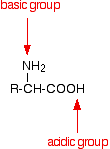
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Jeśli rozpuścimy aminokwas w wodzie, prosty roztwór również zawiera ten jon.
Zwitterion to związek nieposiadający całkowitego ładunku elektrycznego, ale zawierający oddzielne części naładowane dodatnio i ujemnie.
Dodanie zasady do roztworu aminokwasu
Jeśli zwiększymy pH roztworu aminokwasu przez dodanie jonów wodorotlenkowych, jon wodorowy zostanie usunięty z grupy -NH3+.
![]()

Można wykazać, że aminokwas istniał teraz jako jon ujemny, stosując elektroforezę.
W najprostszej formie elektroforeza może po prostu składać się z kawałka zwilżonej bibuły filtracyjnej na szkiełku mikroskopowym z zaciskiem krokodylowym na każdym końcu podłączonym do baterii. Na środku papieru umieszcza się kroplę roztworu aminokwasu.
Chociaż roztwór aminokwasu jest bezbarwny, jego położenie po pewnym czasie można stwierdzić, spryskując go roztworem ninhydryny. Jeśli papier wyschnie, a następnie zostanie delikatnie podgrzany, aminokwas pojawi się jako kolorowa plamka.
Aminokwas będzie przemieszczał się w kierunku anody (elektrody dodatniej).
Dodanie kwasu do roztworu aminokwasu
Jeśli zmniejszymy pH przez dodanie kwasu do roztworu aminokwasu, część -COO- zwitterionu odbierze jon wodorowy.
![]()
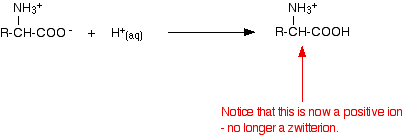
Tym razem, podczas elektroforezy, aminokwas przemieściłby się w kierunku katody (elektrody ujemnej).
Zmienianie pH z jednej skrajności w drugą
Załóżmy, że zaczniemy od jonu, który właśnie wytworzyliśmy w warunkach kwaśnych i powoli będziemy dodawać do niego zasady.
Jon ten zawiera dwa kwaśne hydrogeny – jeden w grupie -COOH i jeden w grupie -NH3+.
Najbardziej kwaśnym z nich jest ten w grupie -COOH, a więc jest on usuwany jako pierwszy – i wracamy do zwitterionu.
![]()
![]()
Więc po dodaniu odpowiedniej ilości zasady, aminokwas nie ma już ładunku dodatniego lub ujemnego netto. Oznacza to, że podczas elektroforezy nie będzie się przemieszczał w kierunku katody lub anody.
PH, przy którym ten brak ruchu podczas elektroforezy ma miejsce, jest znany jako punkt izoelektryczny aminokwasu. To pH różni się w zależności od aminokwasu.
Jeśli będziesz dalej dodawać jony wodorotlenkowe, otrzymasz reakcję, którą już widzieliśmy, w której jon wodorowy jest usuwany z grupy -NH3+.
![]()
![]()