WPROWADZENIE
Śródmiąższowe choroby płuc stanowią niezwykle heterogenną grupę zaburzeń, których wspólną cechą jest istnienie komponentu zapalnego w miąższu płuc, który może ostatecznie przekształcić się w zwłóknienie i który powoduje, z funkcjonalnego punktu widzenia, zmiany restrykcyjne, które mogą ostatecznie prowadzić do niewydolności oddechowej.
Mimo że są to choroby, których diagnostyka i leczenie odbywa się w wyspecjalizowanej dziedzinie pneumologii, leczenie jest zasadniczo prowadzone w warunkach ambulatoryjnych, a biorąc pod uwagę, że może ono być i często jest przerywane różnymi powikłaniami, ważne jest, aby lekarz podstawowej opieki zdrowotnej znał aktualne wytyczne dotyczące leczenia tych chorób, ponieważ niejednokrotnie będzie konsultowany przez pacjentów z tego typu problemami, czy to z powodu powikłań ze strony układu oddechowego, czy też powikłań innego rodzaju.
Celem tego przeglądu jest uaktualnienie metod terapeutycznych, które mogą być obecnie oferowane tym pacjentom. Uważamy, że niezwykle ważne jest nie tylko posiadanie przez lekarza podstawowej opieki zdrowotnej aktualnej wiedzy na ten temat, ale także współpraca z pulmonologiem w celu osiągnięcia dobrego przestrzegania przez pacjenta zasad leczenia oraz wczesnego wykrywania i leczenia ewentualnych powikłań.
Wśród chorób śródmiąższowych największe znaczenie ze względu na częstość występowania i ciężkość przebiegu ma idiopatyczne włóknienie płuc (IPF). Z drugiej strony, jej leczenie jest modelem, na którym opiera się leczenie prawie wszystkich tych chorób, z wyjątkiem tych, w których można znaleźć znany czynnik etiologiczny, ponieważ w tych przypadkach eliminacja tego czynnika będzie podstawową podstawą terapii. Skupimy się zatem na przeglądzie aktualnych wytycznych dotyczących postępowania w IPF. Na początku przedstawimy krótką charakterystykę kliniczną, a następnie szczegółowo omówimy aktualne postępowanie w IPF.
OPIS KLINICZNY
IPF prawdopodobnie reprezentuje najbardziej agresywny prototyp rozlanych śródmiąższowych pneumopatii. Częstość jej występowania jest szacowana przez niektórych autorów na 5 przypadków na 100 000 mieszkańców1, choć w rzeczywistości nie jest znana. Jej patogeneza związana jest ze zmianami w złożonych szlakach układu immunologicznego2,3. 2,3 Z tego powodu większość stosowanych leków to leki immunosupresyjne.
Najczęstszym objawem klinicznym jest duszność o podstępnym początku z towarzyszącym suchym kaszlem, który może być najbardziej uciążliwym objawem dla pacjenta ze względu na napadowy i bezdechem charakter. Na ogół duszność jest początkowo nie do opisania, a do wczesnego rozpoznania konieczne jest zachowanie wysokiego wskaźnika podejrzliwości. Czasami przebieg jest gwałtowny od początku i w ciągu kilku miesięcy prowadzi do nieodwracalnej niewydolności oddechowej, co było charakterystyczne dla początkowych opisów Hammana i Richa. Najczęściej jednak dolegliwości występują od kilku miesięcy, kiedy pacjent zgłasza się na pierwszą wizytę.
W badaniu fizykalnym bardzo charakterystyczne są drobne, suche trzaski (velcro rales), które można usłyszeć w ponad 80% przypadków. W zaawansowanych przypadkach może pojawić się duszność przy niewielkim wysiłku, a nawet sinica warg. Acropaquias mogą być widoczne w około 30-50% przypadków. Podejrzenie IPF nasila się, gdy na zdjęciu rentgenowskim klatki piersiowej i w tomografii komputerowej pojawiają się takie objawy, jak wzór siatkowaty, obszary nacieków szklistych i zmniejszenie objętości płuc. Ostatecznie badanie czynnościowe potwierdzi istnienie wzorca restrykcyjnego, a analiza gazów w krwi tętniczej potwierdzi istnienie hipoksemii. W wątpliwych przypadkach duże znaczenie ma wykazanie hipoksemii przy wysiłku.
Ostateczne potwierdzenie rozpoznania może przynieść jedynie biopsja płuca. W rzeczywistości jednak, nawet w wielu opublikowanych seriach, przeważają przypadki bez rozpoznania histologicznego. Ostatnio American Thoracic Society (ATS) zaproponowało, że istnienie wszystkich tych kryteriów oznacza, że przy braku narażenia na leki, elementy środowiskowe lub choroby tkanki łącznej rozpoznanie IPF może być najprawdopodobniej postawione bez wykonywania biopsji płuc4 w przypadkach, w których biopsja płuc stanowiłaby niedopuszczalne ryzyko.
Podstawowe śródmiąższowe zapalenie płuc (UIP) jest wzorem histopatologicznym, który identyfikuje tych pacjentów4. Za różne jednostki chorobowe uważa się te, które mają cechy odwarstwiającego śródmiąższowego zapalenia płuc, choroby śródmiąższowej związanej z oddechowym zapaleniem oskrzeli, nieswoistego śródmiąższowego zapalenia płuc, limfoidalnego śródmiąższowego zapalenia płuc, ostrego śródmiąższowego zapalenia płuc i bronchiolitis obliterans z organizującym się zapaleniem płuc.
Po ustaleniu rozpoznania i stopnia ciężkości klinicznej większość chorych wymaga leczenia, ponieważ jest to choroba śmiertelna, bez samoistnej remisji. Odpowiedź na leczenie jest słaba. Pięcioletnie przeżycie wynosi 50%5,2,6-8. Leczenie wymaga około 3-6 miesięcy, zanim skuteczność zostanie osiągnięta. Doniesienia na temat leczenia tych chorób są skąpe: niekontrolowane próby terapeutyczne obejmujące głównie niewielką liczbę pacjentów9.
Mimo nieuchronnej podstępnej i nieodwracalnej progresji choroby, nihilizm terapeutyczny nie jest uzasadniony. Istnieją przykłady nieleczonego zwłóknienia z powolną progresją prowadzącą do nieodwracalnego zwłóknienia niereagującego na leczenie lub rozwijającego się w fazie szybko postępującej. Wszystkie prawdopodobnie wymagają leczenia w momencie zgłoszenia. Jednak pacjenci z przeciwwskazaniami do leczenia lub ci, u których nie ma dowodów na upośledzenie funkcji, mogą być objęci programem obserwacji w odstępach 3-6 miesięcy. Trudne jest również postępowanie z chorymi w podeszłym wieku z przewagą włóknienia i ciężkim upośledzeniem czynności płuc. Pacjenci ci otrzymują krótkie leczenie trwające 3-6 miesięcy w celu określenia odwracalności. Niewiele z nich będzie miało pozytywną odpowiedź.
Często trudno jest określić, czy leczenie przynosi pożądany efekt. Często występuje subiektywna poprawa (nawet u 70% pacjentów). Obiektywna poprawa występuje u 20-30% chorych. Parametrami najczęściej stosowanymi do określenia funkcjonalnej (obiektywnej) poprawy jest wzrost całkowitej pojemności płuc (TLC) lub pojemności życiowej (VC), wzrost pojemności dyfuzyjnej oraz zmniejszenie lub normalizacja spadku SaO2 podczas wysiłku4,10-12.
LECZENIE
Kortykosteroidy
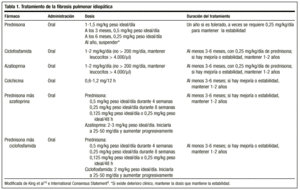
Kortykosteroidy są podstawą leczenia IPF, chociaż ich skuteczność jest raczej niewielka: korzystna odpowiedź występuje u jednej trzeciej pacjentów. Uzasadnieniem dla ich stosowania jest tłumienie przewlekłego zapalenia pęcherzyków płucnych. Uważa się, że działają one poprzez hamowanie migracji neutrofilów i limfocytów w płucach, poprzez zmniejszenie stężenia immunokompleksów, zmianę funkcji makrofagów pęcherzykowych i przylegania neutrofilów do powierzchni śródbłonka.
Nie jest jasne, dlaczego niektórzy pacjenci odpowiadają, a inni nie. Może to być związane z obecnością receptorów powierzchniowych na komórkach miąższowych płuc. Krótki czas trwania objawów, łagodne upośledzenie czynnościowe i radiologiczne, płeć żeńska i młodszy wiek pacjentów wydają się wiązać z lepszym wynikiem leczenia.
Jednakże, mimo że jest to najczęściej stosowana metoda leczenia, jej długoterminowe działanie nie zostało potwierdzone w żadnym prospektywnym, pojedynczo zaślepionym, kontrolowanym placebo badaniu.
Izumi i wsp. przeanalizowali przeżycie 222 pacjentów i stwierdzili, że w ciągu 10 lat nie było różnicy w przeżyciu między osobami, które otrzymywały steroidy w porównaniu z pacjentami nieleczonymi13. Niemniej jednak, gdy pacjent z IPF zgłasza się z upośledzoną czynnością płuc lub objawami, które przeszkadzają w normalnym życiu, uzasadnione jest podjęcie próby leczenia steroidami. W rzeczywistości spontaniczna poprawa jest bardzo rzadka, a jeśli podejmuje się decyzję o opóźnieniu rozpoczęcia leczenia, powinno się to odbywać kosztem ścisłego monitorowania pacjenta, tak aby można było rozpocząć leczenie, gdy tylko pogorszenie jest widoczne.
Klasyczne leczenie rozpoczyna się od prednizonu w dawce 1,5-2 mg/kg idealnej masy ciała/dobę jako pojedynczej dawki rano, nie przekraczając dawki 100 mg. Po 2-3 miesiącach pacjent jest ponownie oceniany za pomocą radiografii i badania funkcjonalnego. Jeśli pacjent odpowiada na leczenie, prednizon jest redukowany (1-2 mg/tydzień) do dawki podtrzymującej 0,5 mg/kg idealnej masy ciała/dobę, która może być następnie zmniejszana. Jeśli nie ma odpowiedzi, dodaje się lek immunosupresyjny. Ogólnie rzecz biorąc, jest mało prawdopodobne, aby można było przerwać leczenie, a dawki 0,25 mg/kg idealnej masy ciała/dobę są zwykle utrzymywane.
Ostatnio Amerykańskie i Europejskie Towarzystwa Chorób Klatki Piersiowej, w celu uniknięcia działań niepożądanych tego leku i uzyskania lepszych wskaźników przeżycia, osiągnęły konsensus, aby leczenie rozpoczynać od kombinacji prednizonu lub innego kortykosteroidu w równoważnych dawkach i leku immunosupresyjnego (azatiopryny lub cyklofosfamidu)4: prednizon 0,5 mg/kg idealnej masy ciała/dobę przez 4 tygodnie; 0,25 mg/kg idealnej masy ciała/dobę przez 8 tygodni, a następnie zmniejszanie dawki do 0,125 mg/kg idealnej masy ciała/dobę lub 0,25 mg/kg idealnej masy ciała/48 h.
Nie ma wytycznych co do czasu trwania leczenia; minimalny czas to jeden rok. Możliwe jest, że po miesiącach lub latach może dojść do reaktywacji choroby, w którym to przypadku należy rozpocząć leczenie tymi samymi środkami. W każdym przypadku odpowiedź na leczenie powinna być zawsze oceniana w kategoriach obiektywnej poprawy, a możliwość przewlekłego utrzymywania pacjenta na dawce gwarantującej stabilność powinna być zarezerwowana dla tych przypadków, w których występuje poprawa po podaniu kortykosteroidów, pogorszenie po ich odstawieniu i ponowna poprawa po ponownym zwiększeniu dawki. Dawka wymagana dla każdego pacjenta może być określona tylko w indywidualnych przypadkach, w zależności od reakcji na zmiany dawki. Wielu autorów uważa, że konieczne jest leczenie przez całe życie.14
W przypadku początkowo ciężkiego przebiegu choroby proponowano stosowanie kortykosteroidów w dużych dawkach. Keogh i wsp. stosowali u chorych z ciężką postacią choroby przerywane podawanie kortykosteroidów pozajelitowych w dużych dawkach: metyloprednizolon dożylnie w dawce 2 g raz w tygodniu oraz prednizon doustnie w dawce 0,25 mg/kg/dobę. Uzasadnieniem jest ich wyraźniejszy wpływ na neutrofilowe zapalenie pęcherzyków płucnych (związane ze złym rokowaniem) niż steroidów w małych dawkach15. Praca ta ma jednak pewne niedociągnięcia, takie jak krótka, 6-miesięczna obserwacja, mała liczba pacjentów oraz stosowanie niższych niż standardowe dawek prednizonu9. Początkowe leczenie dużymi dawkami dożylnych kortykosteroidów (metyloprednizolon 250 mg/6 h) było stosowane w celu jak najwcześniejszego opanowania choroby, gdy ma ona szybko postępujący charakter. Nie ma badań kontrolowanych, które pozwoliłyby stwierdzić, czy te metody są skuteczne; wydaje się jednak, że większe dawki mają większą skuteczność, choć działania niepożądane są również większe.14.
AGENETY CYTROKSYKOTOKSYCZNE
Klasycznie były stosowane jako alternatywa dla kortykosteroidów, gdy były one nieskuteczne, a także gdy ich działania niepożądane wykluczają ich dalsze podawanie. Zgodnie z wybitnie praktycznym duchem tego artykułu, dokonamy przeglądu tych środków, które okazały się przydatne w praktyce klinicznej, chociaż, podobnie jak w przypadku kortykosteroidów, brakuje nam długich, prospektywnych i randomizowanych serii, które pozwoliłyby nam dokładnie określić ich rolę w leczeniu IPF.
Azatiopryna
Mechanizm działania opiera się na substytucji puryn w syntezie kwasu dezoksyrybonukleinowego, hamując w ten sposób deaminazę adeninową i dezaktywując limfocyty. Inne efekty obejmują supresję aktywności naturalnych komórek zabójcy, produkcję przeciwciał i cytotoksyczność komórkową zależną od przeciwciał.
Zalecana dawka wynosi 2 mg/kg/dobę, nie przekraczając 200 mg/dobę, przez okres 3-6 miesięcy. Podawanie leku rozpoczyna się od dawki 50 mg/dobę, a w przypadku dobrej tolerancji dawkę zwiększa się w odstępach 1-2 tygodniowych, aż do osiągnięcia planowanej dawki.
Główne działania niepożądane są hematologiczne: leukopenia, niedokrwistość, małopłytkowość, aplazja czerwonokrwinkowa i pancytopenia. Konieczne jest monitorowanie liczby leukocytów, a jeśli spadnie ona poniżej 4000/μl, azatioprynę należy odstawić do czasu ponownego wzrostu tej liczby. Ponadto mogą wystąpić dolegliwości żołądkowo-jelitowe, takie jak nudności i wymioty, choroba wrzodowa, biegunka oraz łagodne podwyższenie aktywności enzymów wątrobowych. W sumie, w 20-30% przypadków, działania niepożądane wymagają odstawienia azatiopryny.
Raghu i wsp. porównali skuteczność wysokich dawek glikokortykoidów w porównaniu z azatiopryną w połączeniu z niskimi dawkami glikokortykoidów. Stosowaniu tego leku towarzyszyła umiarkowana poprawa parametrów czynności układu oddechowego i wydłużenie czasu przeżycia17.
Cyklofosfamid
Jest lekiem alkilującym. Jego sposób działania polega na wyczerpaniu limfocytów i w ten sposób hamuje ich funkcje. Zalecana dawka wynosi 2 mg/kg/dobę jednorazowo, doustnie, zwykle rozważana z 0,25 mg/kg/dobę doustnie podawanego prednizonu, nie przekraczając 200 mg/dobę przez co najmniej 3 miesiące i do 9-12 miesięcy.
Najważniejszym działaniem niepożądanym jest leukopenia. Należy utrzymać całkowitą liczbę leukocytów większą niż 3000/μl lub liczbę neutrofilów większą niż 1500/μl. Inne powikłania to małopłytkowość, krwiomocz wtórny do krwotocznego zapalenia pęcherza moczowego, anoreksja, nudności i wymioty, supresja szpiku kostnego, azoospermia i amenorrhoea, infekcje i nowotwory hematologiczne.
Kolb i wsp. badali 18 pacjentów z IPF w celu określenia skuteczności i bezpieczeństwa pulsacyjnej terapii cyklofosfamidem. Cyklofosfamid podawano z przerwami (1-1,3 g/miesiąc) wraz z doustnym prednizolonem przez rok. Po tym okresie odstawiono cyklofosfamid i kontynuowano dotychczasowe dawki glikokortykosteroidów8 . Obserwowano ich przez co najmniej 14 miesięcy, monitorując QoL, TLC, FEV1, zdolność przenoszenia CO (DLCO), SaO2, a także objawy. U jednego pacjenta konieczne było przerwanie leczenia z powodu nawracających zapaleń płuc; 11 pacjentów uznano za odpowiadających na leczenie (u 5 nastąpiła poprawa, u 6 stabilizacja), a u 6 nastąpiło pogorszenie. Długotrwała toksyczność cyklofosfamidu zależy od dawek kumulacyjnych. Dawki przerywane są równie skuteczne i lepiej tolerowane niż dawki dzienne. Respondenci mieli wyższy odsetek limfocytów w BAL. Na uwagę zasługuje również fakt, że początkowa QOL pacjentów, u których uzyskano odpowiedź na leczenie, była znacząco lepsza ze względu na krótszy czas do progresji, co sugeruje, że leczenie to powinno być rozpoczynane wcześnie.
Baughman i Lower leczyli 33 pacjentów z IPF cyklofosfamidem w dawce 1000-1 800 mg/dobę przez 18 miesięcy. Ci, którzy przeżyli 18 miesięcy mieli znaczącą poprawę w VCF, która utrzymywała się przez kolejny rok. Zmniejszenie dawki prednizolonu było możliwe z 32 do 4 mg/dobę16.
Penicylamina
Środek przeciwwłóknieniowy. Sugeruje się, że poprzez zakłócanie tworzenia wewnątrz- i międzycząsteczkowych wiązań kowalencyjnych włókien kolagenowych hamuje rozwój włóknienia płuc. Opisano niektóre przypadki chorób tkanki łącznej z towarzyszącym zwłóknieniem płuc, w których wykazano pewną skuteczność, ale nie ma kontrolowanych badań na dużych seriach pacjentów, więc nie może być obecnie uważana za ważną alternatywną metodę leczenia. Przed wydaniem rekomendacji konieczne są zatem dalsze badania.
Kolchicyna
Zmniejsza wydzielanie kolagenu i zwiększa aktywność kolagenolityczną. Ma również działanie przeciwzapalne. Potrzebne są badania, aby dokładniej określić jego rolę w leczeniu tej choroby, ale istnieją badania, w których przypisuje się mu skuteczność podobną do kortykosteroidów, a jego działania niepożądane nie są poważne. Zalecany jest w dawce 0,6 mg, raz lub dwa razy na dobę, u pacjentów opornych na kortykosteroidy, samodzielnie lub w skojarzeniu z lekami immunosupresyjnymi. Mimo że są autorzy, którzy umieszczają ją w pierwszej linii leczenia, obecnie brak jest danych pozwalających na jej ustalenie (tabela 1).
PULMONARY TRANSPLANT
Przypadki, w których choroba postępuje bez odpowiedzi na leczenie i kończy się niewydolnością oddechową, są niestety najliczniejsze w tej chorobie. Obecnie nie ma dla tych chorych perspektyw leczenia poza leczeniem paliatywnym. W tym ponurym kontekście w latach 80. pojawiła się możliwość przeszczepienia płuc, która rozwinęła się do tego stopnia, że obecnie stanowi opcję terapeutyczną, która powinna być rozważana jako narzędzie do zastosowania klinicznego i nie jest już ograniczona do dziedziny eksperymentalnej. Najodpowiedniejszym wskazaniem do jego stosowania są osoby poniżej 65 roku życia, u których nie występuje postępująca i nieodwracalna choroba innych narządów, a także nierozwiązane aktywne zakażenie lub zakażenie wieloopornymi drobnoustrojami. Wymagane są również odpowiednie predyspozycje osobnicze i stan odżywienia. Pacjenci z CPT mniejszym niż 60% oczekiwanego lub pojemnością dyfuzyjną płuc mniejszą niż 40% mają przeżycie krótsze niż 2 lata. W tym stopniu dysfunkcji wymagają one tlenoterapii i łatwo ulegają desaturacji przy minimalnym wysiłku fizycznym. W takich przypadkach należy rozważyć przeszczepienie płuc, gdy tylko konieczne stanie się zastosowanie tlenoterapii i stwierdzona zostanie niepowstrzymana progresja choroby. Typem przeszczepu z wyboru jest przeszczep jednego płuca, rezerwując przeszczep dwóch płuc dla przypadków, w których istnieją wątpliwości co do zachowania pozostałego płuca. Jeśli pacjent jest w wieku poniżej 50 lat i ma niewydolność prawego serca, można rozważyć przeszczepienie serca. Jednak w tej sytuacji choroba jest bardzo zaawansowana i jest mało prawdopodobne, aby wytrzymała oczekiwanie18,19. Oczekuje się, że przeżycie po przeszczepie wyniesie 80% w pierwszym roku i 50-60% w ciągu 5 lat, co znacznie poprawia rokowanie dla pacjenta z IPF, u którego doszło do niewydolności oddechowej.
Ocena odpowiedzi na leczenie
W przypadku braku powikłań uzyskanie odpowiedzi na leczenie może trwać do 6 miesięcy. Po tym czasie, jeżeli stan pacjenta uległ poprawie lub jest stabilny, należy utrzymać te same dawki. Jeśli uległy one pogorszeniu, należy przejść do alternatywnej terapii (inny lek immunosupresyjny lub nawet przeszczep). Po 12 miesiącach powinna być ponownie oceniona w ten sam sposób, a po 18 miesiącach zindywidualizowana w zależności od odpowiedzi na leczenie. Se recomienda continuar indefinidamente sólo en aquellos pacientes con mejoría continua o estabilización (tabla 2).

Una respuesta favorable se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Mejoría de los síntomas, sobre todo en el grado de esfuerzo requerido para que el paciente deba parar cuando hace un esfuerzo o un descenso en la frecuencia o gravedad de la tos.
2. Reducción de las alteraciones radiológicas.
3. Mejoría funcional definida por dos o más de los siguientes parámetros:
Aumento >= 10% en la TLC o CV (o >= 200 ml).
Aumento >= 15% en DLCO o >= 3 ml/min/mmHg.
Mejoría o normalización de la SaO2 o pO2 (aumento >= 4% o >= 4 mmHg) durante un prueba de esfuerzo cardiorrespiratoria.
Una respuesta estable (también considerada favorable) se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Cambio de
2. Cambio de
3. Sin cambios en la SaO2 o pO2 (aumento
Un fracaso del tratamiento se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Aumento de los síntomas, sobre todo disnea o tos.
2. Aumento de las alteraciones radiológicas, especialmente imágenes en panal o signos de hipertensión pulmonar.
3. Deterioro funcional definido por dos o más de los siguientes parámetros:
Descenso >= 10% en la TLC o CV (o >= 200 ml).
Descenso >= 15% en DLCO o >= 3 ml/min/mmHg.
Pogorszenie SaO2 (= 4%) lub podwyższenie gradientu pęcherzykowo-tętniczego (AapO2) (= 4 mmHg) w spoczynku lub podczas testu wysiłkowego układu krążenia.
WNIOSKI
Idiopatyczne włóknienie płuc jest chorobą śmiertelną, bez samoistnej remisji i słabo reagującą na leczenie. Badania dotyczące tego ostatniego są nieliczne i obejmują niewielką liczbę pacjentów. Najbardziej akceptowanym schematem jest stosowanie kortykosteroidów przez co najmniej rok w różnych dawkach, samodzielnie lub w połączeniu z innymi lekami immunosupresyjnymi. Ostatnio American Thoracic i European Respiratory Societies4 zalecają stosowanie terapii skojarzonej. Prowadzone są badania nad lekami przeciwzwłóknieniowymi, które mają zapobiec utrwaleniu się procesu włóknienia, a tym samym jego nieodwracalności, ponieważ u wielu chorych proces ten jest rozpoznawany w późnym stadium. Biorąc pod uwagę wskaźniki przeżycia i ewolucji choroby, przeszczepienie płuc powinno być rozważane, gdy tylko chorzy zawodzą w leczeniu i wymagają tlenoterapii. Wszystko to wskazuje na potrzebę przeprowadzenia wieloośrodkowych badań z zamiarem zrekrutowania wystarczającej liczby pacjentów, aby ocenić skuteczność stosowanego leczenia, a także określić naturalną historię choroby oraz rzeczywistą częstość występowania i chorobowość4,20. Z drugiej strony, zaleca się rozpoznanie i rozpoczęcie leczenia we wczesnych stadiach choroby w celu uzyskania wyższych wskaźników przeżycia.