Systematyka: Pierwotnie opisany jako Coluber obsoletus przez Thomasa Saya w 1823 roku na podstawie okazu zebranego w „Isle au Vache do Council Bluffs na rzece Missouri.” Schmidt (1953) ograniczył typowe miejsce występowania do Council Bluffs, Iowa. Dunn (1915a) jako pierwszy użył rodzaju Elaphe dla tego gatunku, ale przeliterował gatunek jako obsoletus. W 1836 roku, Holbrook opisał Coluber alleghaniensis na podstawie okazu znalezionego „na szczycie Blue Ridge w Wirginii.” Ten okaz i inne z Nowego Jorku i gór Karoliny były pierwszymi Eastern Ratsnakes jakie widział, które miały słabo stępione łuski. Nazwa ta została później uznana za młodszy synonim E. obsoletus (= obsoleta) przez Cope’a (1900). Callopeltis obsoletus został użyty dla tego gatunku przez Hay’a (1902), za Lonnbergiem (1894). W oparciu o zgodność danych morfologicznych (Burbrink, 2001, Herpetol. Monogr. 15: 1-53) i mitochondrialnych (Burbrink et al., 2000, Evolution 54: 2107-2118), Burbrink podzielił P. obsoletus na trzy gatunki (P. alleghaniensis, P. obsoletus i P. spiloides) bez podgatunków. P. alleghaniensis jest jedynym gatunkiem występującym w Wirginii.
Opis: Duży, postawny wąż osiągający maksymalną znaną długość całkowitą 2,565 mm (101.0 cali) (Conant i Collins, 1991). W Wirginii maksymalna znana długość pyska-odbytnicy (SVL) wynosi 1,710 mm (67.3 in.), a maksymalna długość całkowita wynosi 2,028 mm (79.8 in.). W tym badaniu, długość ogona/długość całkowita wynosiła średnio 16,9 ± 1,6% (11,2-23,6, n = 209).
Scutellation: Ventrals 214-272 (ave. = 231.8 ± 5.2, n = 232); subcaudals 46-94 (ave. = 80.0 ± 7.4, n = 203); ventrals + subcaudals 275-348 (ave. = 312.1 ± 9.3, n = 201); łuski grzbietowe gładkie bocznie i słabo stępione pośrodku, rzędy łusek zwykle 24-27 (77,1%, n = 251) w połowie ciała, ale mogą być 21-23 lub 28 (22,9%); płytka odbytowa niepodzielona (10,8%) lub podzielona lub częściowo podzielona (89.2%, n = 232); infralabiale 11/11 (47.3%, n = 167), 10/10 lub 10/11 (21.6%), 11/12 lub 12/12 (21.6%), lub inne kombinacje 9-13 (9.5%); supralabiale 8/8 (89.3%, n = 224) lub inne kombinacje 6-9 (10.7%); loreal present; preoculars 1/1; postoculars 2/2; temporals usually 2+3/2+3 (52.4%, n = 229), 2+2/2+3 (13.1%), 2+2/2+2 (10.5%), 2+4/ 2+3 (10.0%), or other combinations of 1-3/2-6 (14./4%).
Koloryzacja i wzór: Ciało jednolicie czarne grzbietowo u dorosłych; niektóre osobniki z niewyraźnymi czarnymi pasami na szaro-czarnym ciele lub z niekompletnie przesłoniętym wzorem młodocianym (patrz poniżej); brzuch z nieregularnym czarno-białym wzorem szachownicy przeplatanym czarnymi smugami, z różem zastępującym biel u niektórych osobników; brzuszny wzór zanika ku tyłowi, stając się całkowicie szary u starszych osobników, ale czarno-biały wzór pieprzu u młodszych osobników; podbródek i przednia część brzucha szyi gładko białe; biały pigment występuje również na dolnej połowie nadoczodołów. Ciało w wyobrażonym przekroju poprzecznym ma kształt bochenka chleba, z płaskim brzuchem.
Dymorfizm płciowy: Nie ma różnic płciowych w kolorze lub wzorze. SVL dorosłego samca (908-1,710, ave. = 1,182.1 ± 187.1, n = 124) była podobna do SVL dorosłej samicy (910-1,590, ave. = 1,136.1 ± 156.0, n = 54). Indeks dymorfizmu płciowego wynosił -0,04. Samce osiągały większe długości całkowite (do 2.028 mm) niż samice (do 1.884 mm). Długość ogona w stosunku do długości całkowitej była większa u samców (ave. = 17,5 ± 1,4%, 15,1-23,6, n = 107) niż u samic (ave. = 15,7 ± 1,3%, 11,2-18,0, n = 47). Średnia liczba łusek brzusznych była nieco wyższa u samic (233,4 ± 7,3, 214-272, n = 50) niż u samców (230,7 ± 3,9, 220-246, n = 112). Średnia liczba łusek podkaudalnych była wyższa u samców (82,5 ± 5,7, 64-94, n = 96) niż u samic (74,3 ± 8,6, 46-88, n = 45), ale średnia liczba ventrali + subcaudali była podobna między płciami (samce 313,3 ± 7,6, 290-337, n = 95; samice 308,4 ± 11,5, 275-348, n = 44).
Juniorki: W przeciwieństwie do dorosłych, młode osobniki wykazują silny wzór czarnych do ciemnobrązowych plam grzbietowych (ave. = 33,5 ± 2,9, 28-40, n = 36) na popielatym, czarno-białym do szarego ciele. Przednie plamy mają przednie i tylne występy na rogach. Brązowo-biały brzuch tworzy wzór szachownicy. Istnieje wyraźna brązowa pręga, która zaczyna się przed okiem i biegnie do krawędzi pyska. Są one połączone brązową wstęgą w poprzek grzbietu głowy. Brzuch ogona ma nieregularną ciemną pręgę wzdłuż każdej strony. U młodocianych osobników wzór jest zwykle niewidoczny przy SVL około 650 mm. Niektóre młode osobniki dorosłe mogą wykazywać słaby wzór plam grzbietowych, który może być również widoczny u dorosłych osobników w niektórych obszarach (patrz „Geographic Variation”). Przy wylęgu młode osobniki w Wirginii miały średnio 284,6 ± 14,2 mm SVL (258-318, n = 48) i 343,9 ± 17,3 mm długości całkowitej (317-391, n = 47) i ważyły 9,4-13,2 g (ave. = 11,7 ± 1,2, n = 21).
Mylące gatunki: Dorosłe Eastern Ratsnakes mogą być mylone z dorosłym Coluber constrictor; jednak ten ostatni ma całkowicie gładkie łuski i okrągłe ciało w przekroju, a biały pigment jest ograniczony do podbródka. Młode osobniki C. constrictor pozbawione są prążków oczno-szczękowych, wzoru szachownicy na brzuchu, występów na przednich plamach grzbietowych i prążków na brzuchu ogona. Posiadają one również 1,5-2 razy więcej plam grzbietowych. Młode osobniki są czasami mylone z małymi Agkistrodon contortrix, ale Eastern Copperheads mają brązowe poprzeczne pasy w kształcie klepsydry i żółtą końcówkę ogona.
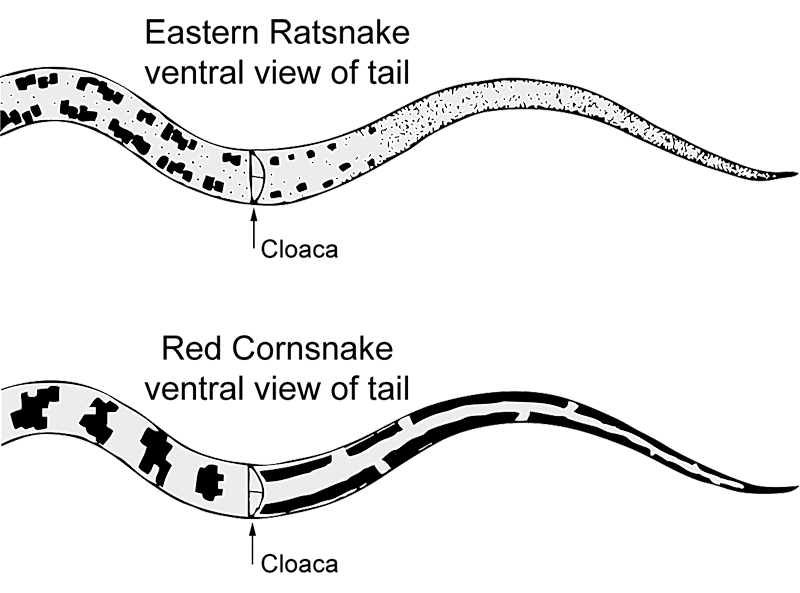
Zmienność geograficzna: Dorosłe Pantherophis alleghaniensis są jednolicie czarne grzbietowo w całej większości Wirginii. Osobniki ze skrajnie południowo-wschodniego narożnika oraz z okolic Greensville County wykazują zróżnicowane ślady czterech podłużnych czarnych pasów na ciemnoszarym tle. Niektóre osobniki w południowo-zachodniej Wirginii, zwłaszcza w hrabstwach Pulaski i Washington, zachowują część młodocianego wzoru, ale zróżnicowanie jest duże. Średnia liczba łusek brzusznych nie różniła się znacząco w zależności od regionu fizjograficznego, wahając się od 229,3 ± 4,8 (220-237, n = 12) na Eastern Shore do 233,9 ± 3,4 (230-243, n = 13) w niższym Piedmont. Średnia liczba łusek podkaudalnych była najniższa w populacjach na południowy zachód od New River w regionie Ridge and Valley (74,9 ± 9,6, 54-82, n = 14) i najwyższa (82,8 ± 6,1, 60-92, n = 35) w północnym Piemoncie. Średnia liczba otworów brzusznych + podoczodołowych była podobna (SW Ridge and Valley 306.8 ± 11.3, 286-318, n = 14; N Piedmont 315.6 ± 6.9, 296-328, n = 35).
Biologia: Eastern Ratsnakes są najczęściej widzianymi wężami w Wirginii. Są one lądowe i arborealne. Występują w wielu typach siedlisk, w tym na terenach rolniczych, w większości typów lasów liściastych, odizolowanych lasach miejskich i zalesionych terenach podmokłych. Węże te są często spotykane w stodołach i starych budynkach, gdzie ich podstawowa ofiara, małe gryzonie, występują w obfitości. Hutchison (1956) znalazł jednego w ustach jaskini. Eastern Ratsnakes są dzienne i nocne. Często są aktywne tuż po zachodzie słońca. W tym czasie przemieszczają się na znaczne odległości i wiele z nich jest zabijanych przez pojazdy na drogach. Gatunek ten doświadcza corocznie dużych strat z powodu tego źródła śmiertelności. Zapiski muzealne dla P. alleghaniensis z Wirginii wskazują na okres aktywności od 3 kwietnia do 8 grudnia. Wiadomo, że krótka aktywność występuje w miesiącach zimowych, ale zależy od warunków pogodowych. Clifford (1976) stwierdził ich aktywność od maja do września w hrabstwie Amelia, a Bazuin (1983) odnotował okres aktywności od 11 marca do 8 listopada w hrabstwie Louisa. Temperatura ciała aktywnych węży wynosiła 25,0-30,6°C (średnia = 27,6 ± 1,9, n = 11). Temperatura węży znalezionych pod ukrytymi obiektami wynosiła 15,0-18,9°C (średnia = 17,5 ± 2,2, n = 3).
Rodenty, ptaki i jaja ptasie są preferowaną zdobyczą P. alleghaniensis. Odnotowano następujące gatunki (Uhler i in., 1939; niniejsze opracowanie): ssaki – wiewiórki wschodnie (Tamias striatus), wiewiórki szare (Sciurus carolinensis), cottontails wschodnie (Sylvilagus floridanus), wiewiórki latające południowe (Glaucomys volans), norniki łąkowe (Microtus pennsylvanicus), norniki sosnowe (Microtus pinetorum), myszy białogłowe (Peromyscus leucopus) i ryjówki krótkoogoniaste (Blarina brevicauda); ptaki – robinie amerykańskie (Turdus migratorius), niebieskie ptaki wschodnie i jaja (Sialia sialis), sasanki żółtobrzuche (Sphyrapicus varius), dzięcioły puchate (Picoides pubescens), kosy szare (Dumetella carolinensis), tracze nurogęsi (Toxostoma rufum), wikłacze (Sturnella magna), wróble śpiewające (Melospiza melodia), kolibry (Archilochus colubris), drozdy wodne (Seiurus noveboracensis), niezidentyfikowana trznadel, „kos” oraz jaja głuszca lub przepiórki; gady: Pięciopręgi (Plestiodon fasciatus) oraz niezidentyfikowane węże i jaja węży; płazy: Lithobates spp. Wąż zjadający tracza nurogęś pożarł rodzica i pisklę. Wiele z porwanych ptaków to pisklęta. Inne ofiary odnotowane dla węży z Wirginii to wschodnie jaszczurki płotowe (Sceloporus undulatus) (Richmond i Goin, 1938) i jaskółki brzegówki (Riparia riparia) Blem, 1979). Dodatkowe rodzaje ofiar dla tego gatunku zostały wymienione w Brown (1979) oraz Ernst i Barbour (1989b). Istnieją liczne obserwacje P. alleghaniensis wspinającego się na drzewa w celu żerowania na ptakach, ich jajach i pisklętach. Węże te są czasami widziane jak zjadają kurze jaja, a czasami przedmioty, które je przypominają. Po złapaniu, ofiary są zabijane przez zwężenie, chociaż jaja są połykane, a następnie rozbijane w gardle. W badaniach przeprowadzonych w Warren County wykazano, że osobniki P. alleghaniensis, które polują za pomocą węchu i wzroku, zjadają więcej terytorialnych samców i karmiących samic nornika łąkowego (Microtus pennsylvanicus) niż nie karmiących samic z powodu zwiększonych zachowań obronnych tych grup (Madison, 1978). Do drapieżników P. alleghaniensis należą jastrzębie (Buteo spp.), wielkie sowy domowe (Bubo virginianus) i wolno żyjące koty domowe (Mitchell i Beck, 1992; C. H. Ernst, pers. comm.).
Ratownice wschodnie są jajorodne i składają jedno jajo w ilości 5-19 sztuk rocznie (średnia = 11,3 ± 3,3, n = 24). Łęgi 21 osobników P. alleghaniensis z północnej Wirginii składały średnio 19,4 jaj (17-24; C.H. Ernst, pers. comm.). Naturalne miejsca składania jaj to stojące i zwalone drzewa dziuplaste, hałdy kompostu i ściółki, stosy trocin i rozkładające się kłody. Niektóre miejsca są wielokrotnie wykorzystywane przez P. alleghaniensis (Bader, 1984). Walki samców czasami poprzedzają gody (Mitchell, 1981b). Znane daty godów przypadają między 26 maja a 9 czerwca. Odnotowane daty składania jaj to 3 czerwca-17 lipca (Tuck i in., 1971; W. H. Martin, pers. comm.; C. A. Pague, pers. comm.; J. C. Mitchell, pers. obs.). Jaja miały średnie wymiary 42,8 ± 6,2 x 24,7 ± 4,3 mm (długość 34,0-57,3, szerokość 19,3-39,5, n = 61) i ważyły 9,0-13,1 g (ave. = 11,6 ± 0,8, n = 26). Wszystkie zmierzone przeze mnie dojrzałe samce i samice miały ponad 900 mm SVL. Długość inkubacji wynosiła 60-65 dni, a lęgi pojawiły się 30 sierpnia-30 września.
Jest to najczęściej spotykany wąż w Wirginii. Z 278 węży odnotowanych w ciągu 4 lat w Amelia County, 105 było Eastern Ratsnakes (Clifford, 1976). W Blue Ridge Mountains, Martin (1976) zauważył, że 76 z 545 węży, które znalazł na drogach było tego gatunku. Shekel et al. (1980) znaleźli zagęszczenie 0.23 węża na hektar w Maryland, a Fitch (1963b) znalazł 1 na hektar w Kansas. Dorosłe węże wschodnie zajmują obszar domowy o średnicy do 600 m, a te same obszary domowe są zajmowane przez wiele lat, a być może przez całe życie (Stickel i in., 1980). Maksymalne odległości, na jakie się przemieszczają to ponad 1300 m. Węże te zwykle wielokrotnie korzystają z jednego miejsca schronienia w sezonie aktywnym i z tego samego hibernakulum przez wiele lat. Najczęstszymi hibernakulami są drzewa dziuplaste i pniaki. Zazwyczaj są to pojedyncze węże. Wiadomo, że czarne węże szczurowate gromadzą się zimą, czasami w tych samych norach, w których hibernują miedziogłowy wschodnie (Agkistrodon contortrix). Takie miejsce zostało odkryte 15 kwietnia 1967 roku w stosie spróchniałych drew w hrabstwie Loudoun przez W. H. Martina (pers. comm.).
Uwagi: Inne nazwy zwyczajowe w literaturze z Wirginii to pilot snake (Cope, 1900), Alleghany blacksnake (Hay, 1902), scaly lub rusty black snake i pilot snake (Dunn, 1915a), tree black snake (Dunn, 1936), mountain blacksnake (Burch, 1940), pilot blacksnake (Burch, 1940; Conant, 1945) i chicken snake (Linzey i Clifford, 1981).
Wiara, że wschodnie węże i wschodnie głowacze miedziane hybrydyzują i produkują potomstwo, które jest jadowite i wygląda jak wschodnie węże jest mitem. Te dwa gatunki są tylko daleko spokrewnione (różne rodziny), wskazując, że zgodne kojarzenie i produkcja zdolnego do życia potomstwa jest wysoce nieprawdopodobna. Inne historie o czarnych wężach (przypuszczalnie Eastern Ratsnakes) są powszechne. Beck (1952) wspomina kilka mitów, w które wierzyli ludzie w Rappahannock County w 1948 roku, włączając w to wschodnie węże będące w stanie zabić grzechotniki ziołami, stać na ogonie, doić krowy, czarować ptaki i dzieci. Mit, że wschodnie węże prowadzą miedzianogłowe i grzechotniki do bezpiecznego miejsca, mógł spowodować nadanie temu gatunkowi nazwy „pilot” (Ernst i Barbour, 1989b).
Okazy albinosów lub częściowych albinosów P. alleghaniensis zostały zgłoszone z trzech miejsc w Wirginii: Westmoreland County (Hensley, 1959), Rockbridge County (Carroll, 1950) i Washington County (D. W. Ogle, pers. comm.). Te dwa ostatnie węże zachowały młodzieńczy wzór, ale nie miały czarnego pigmentu.
Mitchell et al. (1982) opisali niezwykłe zachowanie autofagii (samozjadania) u młodego P. alleghaniensis z Chesterfield County. Wąż został poddany nagłej zmianie temperatury, zaczął gryźć własny ogon, połknął go całkowicie (wraz z tak dużą częścią reszty ciała, jak tylko mógł) i zdechł. W wyniku tego powstały trzy koncentryczne spirale, jedna zewnętrzna i dwie wewnętrzne, o średnicy 4 cm.
Ratownice wschodnie sporadycznie wchodzą do transformatorów, zostają porażone prądem i powodują przerwy w dostawie prądu. Jeden z takich incydentów pozostawił 13 000 domów bez prądu w Chesterfield County (Richmond Times-Dispatch, 29 maja 1991).
Ochrona i zarządzanie: Obfitość i powszechne występowanie tego gatunku oraz jego zdolność do przetrwania w wielu różnych siedliskach wskazują, że P. alleghaniensis wymaga obecnie niewielkiej ochrony i aktywnego zarządzania. Jednakże, każdego roku setki osobników giną na autostradach w Wirginii, co jest źródłem śmiertelności, do której zmniejszenia może przyczynić się edukacja społeczeństwa na temat węży. Nie wiadomo jak ten gatunek reaguje na fragmentację siedlisk. Gospodarka zapewniająca ciągłość występowania tego gatunku obejmuje utrzymywanie dużych drzewostanów liściastych.