1) Introducere
Tractul de ieșire cardiac (OFT) este o structură tranzitorie la polul arterial al inimii care conectează ventriculii embrionari cu sacul aortic. OFT se formează în timpul buclucașului cardiac din celulele progenitoare cardiace din mezodermul faringian. La extensia sa maximă, OFT este un cilindru miocardic torsionat, căptușit cu celule endocardice, cu domenii proximale (conale) și distale (trunculare) ortogonale, dar contigue. OFT se remodelează ulterior, concomitent cu septarea ventriculară, proces în timpul căruia peretele OFT se rotește și se împarte pentru a genera baza aortei ascendente și a trunchiului pulmonar. Remodelarea OFT este asociată cu formarea unui sept de ieșire, morfogeneza valvei semilunare, arteriogeneza coronariană și maturarea componentelor miocardice și musculare netede ale bazei marilor artere. Perturbarea genetică sau de mediu a elongației și remodelării OFT duce la defecte cardiace conotrunculare congenitale, care reprezintă 30 % din toate defectele cardiace congenitale (aproximativ 0,3 % din nașterile vii) (Bruneau, 2008; Srivastava și Olson, 2000). Studii anatomice, experimentale și genetice extinse ale morfogenezei OFT au evidențiat implicarea mai multor tipuri de celule și căi de semnalizare în dezvoltarea OFT, sugerând că complexitatea dezvoltării stă la baza incidenței ridicate a anomaliilor OFT la om.
2) Formarea OFT
În timpul alungirea tubului cardiac, miocardul este adăugat progresiv la polul arterial al inimii de la o populație de celule progenitoare din mezodermul faringian denumită al doilea câmp cardiac (SHF; Figura 1A) (Buckingham et al., 2005; Kelly și Buckingham, 2002), (Cai și colab., 2003). SHF este poziționat în mezoderm medial, dar contiguu la celulele care dau naștere tubului cardiac timpuriu; ulterior, celulele SHF stau sub nivelul endodermului ventral al foregutului, constituind peretele dorsal al cavității pericardice. SHF contribuie la ventriculul drept, pe lângă polul venos și regiunile AV ale inimii; acea populație de celule progenitoare care contribuie exclusiv la polul arterial este cunoscută sub numele de câmp cardiac anterior sau secundar. Au fost identificați regulatori transcripționali critici ai dezvoltării SHF, printre care se numără factorii de transcripție Isl1, Foxh1, Tbx1, Pitx2 și Mef2c (analizați în (Buckingham et al., 2005)). Proprietățile cheie ale SHF includ poziția sa medială, întârzierea diferențierii și proliferarea ridicată în raport cu celulele care dau naștere tubului cardiac timpuriu. Aceste proprietăți sunt reglementate atât în mod intrinsec, cât și de celulele CNC înconjurătoare și de ectodermul și endodermul faringian prin activitatea moleculelor de semnalizare a căilor factorului de creștere a fibroblastelor, a proteinei morfogenetice osoase, Hedgehog și Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Împreună, aceste semnale definesc nișa care menține celulele progenitoare SHF și reglează desfășurarea lor progresivă în timpul extinderii OFT (Rochais et al., 2009). OFT este căptușit de celule endocardice despre care se crede că derivă, de asemenea, din mezodermul faringian (Laugwitz et al., 2008).
În timpul alungării tubului cardiac, miocardul este adăugat progresiv la polul arterial al inimii de la o populație de celule progenitoare din mezodermul faringian denumită al doilea câmp cardiac (SHF; Figura 1A) (Buckingham et al., 2005; Kelly și Buckingham, 2002), (Cai et al., 2003), (Cai et al., 2003). SHF este poziționat în mezoderm medial, dar contiguu la celulele care dau naștere tubului cardiac timpuriu; ulterior, celulele SHF stau sub nivelul endodermului ventral al foregutului, constituind peretele dorsal al cavității pericardice. SHF contribuie la ventriculul drept, pe lângă polul venos și regiunile AV ale inimii; acea populație de celule progenitoare care contribuie exclusiv la polul arterial este cunoscută sub numele de câmp cardiac anterior sau secundar. Au fost identificați regulatori transcripționali critici ai dezvoltării SHF, printre care se numără factorii de transcripție Isl1, Foxh1, Tbx1, Pitx2 și Mef2c (analizați în (Buckingham et al., 2005)). Proprietățile cheie ale SHF includ poziția sa medială, întârzierea diferențierii și proliferarea ridicată în raport cu celulele care dau naștere tubului cardiac timpuriu. Aceste proprietăți sunt reglementate atât în mod intrinsec, cât și de celulele CNC înconjurătoare și de ectodermul și endodermul faringian prin activitatea moleculelor de semnalizare a căilor factorului de creștere a fibroblastelor, a proteinei morfogenetice osoase, Hedgehog și Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Împreună, aceste semnale definesc nișa care menține celulele progenitoare SHF și reglează desfășurarea lor progresivă în timpul extinderii OFT (Rochais et al., 2009). OFT este căptușită de celule endocardice despre care se crede că derivă, de asemenea, din mezodermul faringian (Laugwitz et al., 2008).
În timpul formării OFT, polul arterial al inimii este deplasat caudal în regiunea faringiană pe măsură ce are loc morfogeneza arcului faringian și formarea arterelor arcului aortic bilateral (Waldo et al., 2005b). Celulele CNC, derivate din tubul neural dorsal, migrează prin arcurile faringiene caudale în OFT al inimii în timpul formării regiunii distale a OFT (figura 1B) (Hutson și Kirby, 2003). Pe lângă rolul critic în remodelarea OFT, celulele CNC joacă un rol timpuriu în limitarea proliferării și în controlul desfășurării SHF (Waldo et al., 2005a). Pe măsură ce celulele CNC intră în OFT distal, celulele endoteliale din regiunea proximală a OFT suferă un proces de tranziție de la epitelial la mezenchimal ca răspuns la semnalele derivate din miocard, pentru a forma, împreună cu celulele crestei neurale invadatoare, perne OFT între straturile miocardice și endoteliale (Sugishita et al., 2004b). Convergența pernelor OFT într-o structură spiralată separă fluxul laminar din ventriculii embrionari stâng și drept. Dezvoltarea pernelor depinde de mai multe căi de semnalizare intercelulară, inclusiv factorul de creștere transformant b, factorul de creștere a fibroblastelor, proteina morpogenetică osoasă, VEGF, Notch și semnalizarea Wnt necanonică (Wagner și Siddiqui, 2007). OFT atinge lungimea maximă la jumătatea gestației la șoarece (E10,5) sau în a 4-a săptămână de dezvoltare la om.
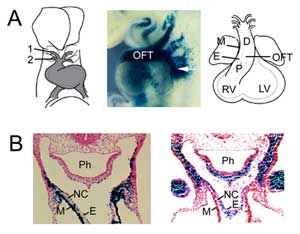
Figura 1
Formarea OFT. (A) OFT în ziua embrionară 8,5 a șoarecelui este conectat la prima (1) și a doua (2) artere ale arcului aortic (stânga) și se extinde prin adăugarea de celule progenitoare ale celui de-al doilea câmp cardiac din mezodermul faringian (mijloc, săgeată), vizualizate cu o transgenă Fgf10 enhancer trap la E9,5. OFT atinge lungimea maximă în ziua embrionară 10,5 a șoarecelui și este alcătuit din regiunile proximală (P) și distală (D). (B) Comparație a expresiei transgenei Fgf10 în OFT și al doilea câmp cardiac (stânga) cu celulele derivate din creasta neurală (dreapta) în OFT distal la E9,5. Panoul din dreapta este reprodus din Jiang et al., 2001, Development 127:1607-16, cu permisiune. M, miocard; E, endocard; RV, ventriculul drept; LV, ventriculul stâng; Ph, faringe; NC, celule derivate din creasta neurală.
3) Remodelarea OFT
În timpul remodelării OFT, ventriculul stâng dobândește o ieșire independentă, aorta ascendentă, oferind o conductă sistemică critică pentru sângele oxigenat la naștere. OFT cilindrică se transformă în baza aortei ascendente și a trunchiului pulmonar (ieșirea ventriculului drept) concomitent cu septarea atrioventriculară și remodelarea arterei arcului aortic între zilele 10,5 și 14,5 de gestație a șoarecilor. Remodelarea OFT este un proces complex la care contribuie atât genetica, cât și hemodinamica (Yashiro et al., 2007). Rolul critic al dezvoltării pernei OFT și al celulelor CNC în acest proces este stabilit (Sugishita et al., 2004b). Miocardul OFT proximal este încorporat în ieșirea ventriculară și un proces de miocardizare invazivă duce la musculificarea septului de ieșire proximal (Rana et al., 2007; van den Hoff et al., 2001). Înglobarea septului aorticopulmonar între arterele a 4-a și a 6-a ale arcului aortic separă OFT distal în aorta ascendentă și trunchiul pulmonar (figura 2A). Pereții musculari netezi se dezvoltă la baza marilor artere din contribuția finală a celui de-al doilea câmp cardiac și mai distal din CNC (Sugishita et al., 2004b; Waldo et al., 2005b).
Septarea OFT este însoțită de rotația peretelui OFT în sens invers acelor de ceasornic, ceea ce duce la alinierea aortei cu ventriculul stâng și a trunchiului pulmonar cu ventriculul drept (Bajolle et al., 2006). Acest proces de septare este finalizat prin convergența septurilor OFT, atrioventriculare și ventriculare (figura 2A). Peretele miocardic distal original al OFT contribuie, în parte, la miocardul subpulmonar al ventriculului drept și, în parte, suferă o moarte celulară programată determinată de hipoxie în timpul alinierii ventriculoarteriale (Rana et al., 2007; Sugishita et al., 2004a). În timpul procesului de remodelare, valvele semilunare se formează la joncțiunea unghiulară a regiunilor proximale și distale ale OFT din pernele OFT originale și cele două perne OFT intercalate (Anderson et al., 2003). Arteriogeneza coronariană este procesul prin care plexul coronarian derivat epicardic invadează selectiv baza aortei deasupra celor două foițe valvulare orientate spre trunchiul pulmonar, formând ostii care conectează sistemul coronarian cu aorta ascendentă (figura 2B) (Tomanek, 2005).
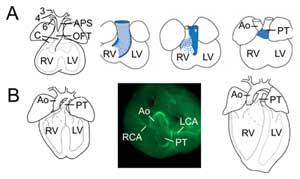
Figură 2.
Remodelarea tractului de evacuare. (A) În ziua embrionară 11,5, OFT este conectat la arterele a treia (3), a patra (4) și a șasea (6) artere ale arcului aortic (stânga). Septul aorticopulmonar (APS) separă OFT distal în aorta ascendentă (Ao) și trunchiul pulmonar (PT) care converg cu pernele OFT (C). Cele trei imagini din dreapta arată rotația progresivă a peretelui miocardic în timpul septării OFT: peretele dorsal în ziua embrionară 10,5 (albastru) dă naștere la miocardul subpulmonar ventral. (B) În ziua embrionară 14,5, septarea OFT este completă și aorta este conectată la ventriculul stâng și trunchiul pulmonar la ventriculul drept. Într-o vedere superioară (mijloc), imunochimia cu actină musculară netedă relevă conexiunile arterelor coronare stângi (LCA) și drepte (RCA) la baza aortei. Structura inimii definitive (dreapta). VD, ventriculul drept; LV, ventriculul stâng.
4) Defecte cardiace conotrunculare congenitale
Complexitatea subiacentă a dezvoltării OFT se reflectă în incidența ridicată a anomaliilor conotrunculare la om (Bruneau, 2008; Srivastava și Olson, 2000). Eșecul desfășurării SHF sau CNC sau al remodelării OFT contribuie la spectrul de defecte conotruncale observate în patologia umană și în modelele animale (figura 3) (Moon, 2008).
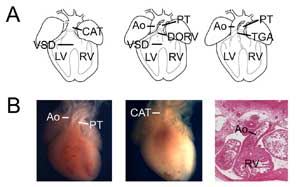
Figura 3.
Defecte cardiace congenitale. (A) Desene animate care prezintă trunchiul arterial comun (sau truncus arteriosus persistant, CAT, stânga), ventriculul drept cu dublă ieșire (DORV, mijloc) și transpoziția marilor artere (TGA, dreapta). DSV, defect septal ventricular; VD, ventriculul drept; LV, ventriculul stâng, Ao, aorta; PT, trunchiul pulmonar. (B) Exemple de modele de șoareci de defecte cardiace congenitale. Inimă de control care prezintă aorta și trunchiul pulmonar (stânga) în comparație cu o inimă nulă Tbx1 (mijloc) cu o singură ieșire ventriculară (CAT). Exemplu de ventricul drept cu dublă ieșire de tip transpoziție care arată aorta conectată cu ventriculul drept într-o inimă nulă Tbx3 (dreapta).
În timp ce afectarea severă a dezvoltării SHF duce la eșecul alungirea tubului cardiac, defectele mai ușoare duc la anomalii de aliniere ventriculoarterială și la eșecul aortei de a stabili o conexiune independentă cu ventriculul stâng (Abu-Issa și Kirby, 2007). Aceste defecte pot fi intrinseci la SHF sau pot afecta tipurile de celule din jur (CNC sau epiteliile faringiene) care controlează nișa celulelor progenitoare ale SHF. Astfel de defecte pot avea ca rezultat ventriculul drept cu dublă ieșire, aorta suprapusă, hipoplazia pulmonară, atrezia pulmonară și tetralogia lui Fallot. Pierderea sau reducerea CNC duce la eșecul sau la întârzierea septării OFT, ceea ce are ca rezultat truncus arteriosus persistent sau ventriculul drept cu dublă ieșire; deficiența CNC afectează, de asemenea, în mod indirect dezvoltarea SHF, ceea ce duce la un fenotip compozit de aliniere și septare (Hutson și Kirby, 2003). Eșecul de rotație a peretelui OFT în timpul remodelării OFT duce, de asemenea, la defecte de aliniere, inclusiv transpoziția marilor artere, ventriculul drept cu dublă ieșire și aorta suprapusă, de obicei ca urmare a unor defecte de lateralitate embrionară (Bajolle et al., 2006; Bamforth et al., 2001). Defectele de formare a septului OFT pot rezulta, de asemenea, din eșecul ulterior al diferențierii peretelui miocardic și din anomalii în procesele esențiale pentru remodelare, cum ar fi moartea celulară programată sau miocardizarea (Park et al., 2008). S-a demonstrat, de asemenea, că defectele intrinseci ale celulelor endocardice OFT, precum și modificările hemodinamice, conduc la anomalii OFT 16, (Zhang et al., 2009), (Bartman și Hove, 2005; Yashiro et al., 2007). În cele din urmă, modelarea anormală a arterelor coronare proximale este frecvent asociată cu defectele conotrunculare și, în mod izolat, este o cauză semnificativă de moarte cardiacă subită (Angelini et al., 2002). Printre obiectivele actuale de cercetare se numără o mai bună înțelegere a etiologiei defectelor conotruncale prin identificarea mutațiilor genetice cauzale și a modificatorilor prin ecrane genomice largi și disecția contribuției relative a actorilor genetici și epigenetici în formarea și remodelarea OFT folosind modele animale. Aceste studii vor oferi informații despre căile de semnalizare și procesele celulare care conduc morfogeneza OFT și care sunt țintele mecanismelor de boală.