La nivel mondial, 36 de milioane de persoane suferă de pierderea totală a vederii1. Aceștia nu pot vedea forme sau chiar surse de lumină. Pentru cei mai mulți dintre acești oameni, orbirea lor provine din probleme rectificabile, cum ar fi cataracta – pur și simplu nu au acces la asistență medicală adecvată. Cu toate acestea, milioanele de persoane rămase sunt oarbe ca urmare a unor afecțiuni care în prezent nu au un tratament eficient.
„Orbirea este una dintre cele mai importante afecțiuni care pot schimba viața unei persoane”, spune William Hauswirth, oftalmolog la Universitatea din Florida din Gainesville. Pe lângă dificultățile pe care le provoacă în ceea ce privește mobilitatea și găsirea unui loc de muncă, deficiența vizuală este asociată cu o serie de alte probleme de sănătate, inclusiv insomnie, anxietate și depresie și chiar risc de sinucidere. „Restabilirea vederii utile ar aduce o îmbunătățire aproape inimaginabilă a calității vieții”, spune Hauswirth.
În țările cu venituri ridicate în care cauzele prevenibile ale deficiențelor de vedere sunt abordate în mod curent, principala cauză a orbirii este degenerarea retinei. Aflat în partea din spate a ochiului, acest țesut conține celule specializate care reacționează la lumină și procesează semnalele vizuale și, prin urmare, este esențial pentru vedere. Celulele fotoreceptoare – neuronii cunoscuți în mod obișnuit sub numele de bastonașe și conuri – convertesc lumina care lovește retina în semnale electrochimice. Aceste semnale se filtrează apoi printr-o rețea complexă de alți neuroni, inclusiv celule bipolare, celule amacrine și celule orizontale, înainte de a ajunge la neuronii cunoscuți sub numele de celule ganglionare retiniene. Proiecțiile lungi, sau axonii, ale acestor celule formează nervul optic, de-a lungul căruia semnalele de la retină sunt transportate către cortexul vizual al creierului, unde sunt interpretate sub formă de imagini.
Dezordinele retiniene implică, de obicei, pierderea celulelor fotoreceptoare, ceea ce diminuează sensibilitatea ochiului la lumină. În unele afecțiuni ale retinei, inclusiv degenerescența maculară legată de vârstă (AMD), această pierdere rezultă din insuficiența celulelor epiteliale care formează un strat în partea din spate a retinei, cunoscut sub numele de epiteliu pigmentar retinian (RPE). RPE menține sănătatea celulelor fotoreceptoare prin curățarea subproduselor toxice produse în timpul reacției cu lumina, precum și prin furnizarea de nutrienți. În tulburările retinei în care fotoreceptorii rămân în formă bună, principala cauză a orbirii este degenerarea celulelor ganglionare ale retinei.
Ascultați o versiune audio a acestui articol
Browserul dumneavoastră nu acceptă elementul audio.
Varietatea cauzelor tulburărilor de vedere face mai dificilă găsirea de soluții. Dar progresele în mai multe domenii fac să crească speranța că aproape toate formele de afecțiuni ale retinei ar putea deveni tratabile.
Una dintre abordări este de a mări sau de a ocoli ochii afectați cu proteze funcționale. Astfel de ochi bionici pot restabili doar o vedere limitată în prezent, dar cercetătorii continuă să împingă capacitățile dispozitivelor. O altă opțiune este terapia genică. Deja disponibilă pentru persoanele cu mutații genetice specifice, cercetătorii caută să extindă această abordare la mai multe persoane și afecțiuni. Unii oameni de știință urmăresc, de asemenea, tratamente bazate pe o tehnică conexă cunoscută sub numele de optogenetică, care presupune modificarea genetică a celulelor pentru a restabili sensibilitatea la lumină a retinei. Aceste lucrări se află într-un stadiu incipient, dar cercetătorii speră că această abordare va putea ajuta, în cele din urmă, o gamă largă de persoane, deoarece este agnostică față de cauzele degenerării retinei. Iar eforturile de a înlocui celulele pierdute sau deteriorate ale retinei, fie in situ, fie prin transplanturi de celule, lasă să se înțeleagă că, în cele din urmă, chiar și afecțiunile retiniene în stadiu avansat ar putea deveni tratabile.
Multe dintre aceste cercetări se află în fază incipientă. Dar Hauswirth este optimist cu privire la progresele care au fost deja realizate. În urmă cu zece ani, spune el, de multe ori trebuia să le spună pacienților că nu poate face nimic pentru ei. „Pentru multe dintre aceste boli, acest lucru s-a schimbat total.”
Ochi bionici
Cu aproape 30 de ani în urmă, Mark Humayun, inginer biomedical la University of Southern California din Los Angeles, a început să stimuleze electric retina persoanelor cu orbire. Lucrând cu colegii de la Second Sight Medical Products, o firmă de tehnologie medicală din Sylmar, California, experimentele sale au arătat că o astfel de stimulare poate induce percepția vizuală a unor pete de lumină numite fosfene. După un deceniu de muncă pe animale pentru a stabili cantitatea de curent electric care poate fi aplicată în siguranță la nivelul ochiului și înarmată cu cunoștințe mult sporite despre numărul și tipurile de celule care persistă în retinele umane degenerate, echipa lui Humayun era pregătită să înceapă să lucreze cu oamenii. Între 2002 și 2004, cercetătorii au implantat câte un ochi bionic la fiecare dintre cele șase persoane care aveau orbire totală sau aproape totală la un ochi – primul test de acest gen. Beneficiarii dispozitivului, cunoscut sub numele de Argus I, au declarat că au fost capabili să perceapă fosfene, mișcări direcționale și chiar forme2. În prezent, aproximativ 300 de persoane experimentează lumea prin intermediul succesorului acestui dispozitiv, Argus II, care a fost aprobat de autoritățile de reglementare din Europa în 2011 pentru utilizarea la persoanele cu retinită pigmentară – un grup de afecțiuni genetice rare care provoacă degenerarea celulelor fotoreceptoare. Administrația pentru Alimente și Medicamente din SUA (FDA) i-a urmat exemplul doi ani mai târziu.

Implantul Argus II cuprinde o matrice de electrozi care este atașată la suprafața retinei.Credit: Ringo Chiu/ZUMA /Alamy
Pentru a fi dotat cu un Argus II, pacienții sunt supuși unei intervenții chirurgicale pentru a atașa un cip care conține o matrice de electrozi la suprafața retinei. Pentru a „vedea” cu ajutorul dispozitivului, o cameră video miniaturală montată pe o pereche de ochelari retransmite semnale către o unitate de procesare care este purtată de beneficiar. Procesorul convertește semnalele în instrucțiuni care sunt transmise fără fir către dispozitivul implantat. Electrozii stimulează apoi celulele ganglionare retiniene din partea din față a retinei. Utilizarea protezei este un proces de învățare. Beneficiarii trebuie să își antreneze creierul pentru a interpreta noul tip de informații primite. Și deoarece camera video nu urmărește mișcarea ochiului, aceștia trebuie, de asemenea, să învețe să își miște capul pentru a-și direcționa privirea.
Dispozitivul oferă doar o vedere limitată. Utilizatorii pot detecta sursele de lumină și obiectele cu margini cu contrast ridicat, cum ar fi ușile sau ferestrele, iar unii pot descifra litere mari. Aceste limitări apar în parte pentru că cei 60 de electrozi ai dispozitivului oferă o rezoluție foarte scăzută în comparație cu milioanele de celule fotoreceptoare dintr-un ochi sănătos. Dar chiar și această îmbunătățire minimă poate îmbunătăți considerabil viața oamenilor.
În timp ce Argus II este un implant epiretinian – ceea ce înseamnă că se află pe suprafața retinei – alte dispozitive în curs de dezvoltare sunt concepute pentru a fi plasate sub retină. Aceste implanturi subretiniene pot stimula celulele care sunt mai aproape de cele care introduc în mod normal semnale în retină – celulele fotoreceptoare. Prin stimularea celulelor aflate mai sus în calea vizuală, cercetătorii speră să păstreze o mai mare parte din procesarea semnalelor care este realizată de o retină sănătoasă.
Retina Implant, o companie de biotehnologie cu sediul în Reutlingen, Germania, a construit un implant subretinian care cuprinde fotodiode (dispozitive semiconductoare care transformă lumina în curent electric) care detectează direct lumina care intră în ochi. Astfel, nu mai este nevoie de o cameră video externă, permițând utilizatorilor să își direcționeze privirea în mod natural. Energia este furnizată de o unitate portabilă, prin intermediul unei bobine care este implantată sub piele, deasupra urechii. Alpha AMS, versiunea actuală a sistemului, a primit aprobarea de reglementare în Europa pentru utilizarea la persoanele cu retinită pigmentară.
Pixium Vision din Paris testează un implant fotovoltaic subretinian numit Prima. Sistemul proiectează în ochi semnale de la o cameră video montată pe ochelari, folosind lumina în infraroșu apropiat, a cărei lungime de undă conduce în mod optim fotodiodele din dispozitiv pentru a stimula celulele retinei. Proiectarea imaginilor în acest mod le oferă utilizatorilor un anumit control asupra direcției privirii, deoarece aceștia pot explora scena mișcându-și doar ochii. De asemenea, energia este furnizată de lumina în infraroșu apropiat, ceea ce face ca implantul să fie fără fir, iar intervenția chirurgicală pentru montarea acestuia să fie mai puțin complicată. „Pacienții învață cum să recupereze vederea mai repede, iar rezoluția pare mai bună”, spune José-Alain Sahel, oftalmolog la Universitatea din Pittsburgh, Pennsylvania, care efectuează teste de siguranță ale dispozitivului pe zece persoane cu AMD. „Este la început, dar este foarte promițător.”
Toate aceste dispozitive funcționează numai atunci când în retină rămân celule funcționale. În afecțiunile oculare obișnuite care afectează în principal celulele fotoreceptoare, inclusiv retinita pigmentară și AMD, de obicei rămân câteva celule care pot fi stimulate. Dar atunci când prea multe celule ganglionare retiniene mor, așa cum se întâmplă în cazul retinopatiei diabetice avansate și al glaucomului, astfel de implanturi nu pot fi de ajutor. Pentru persoanele care nu mai au nicio funcție retiniană rămasă, fie din cauza unei boli sau a unei leziuni, o abordare bionică alternativă ar putea fi mai relevantă.
Humayun și colegii săi lucrează la un sistem care ocolește ochiul, trimițând semnale direct la creier. Ideea nu este nouă: în anii 1970, inginerul biomedical american William Dobelle a arătat că stimularea directă a cortexului vizual a declanșat percepția fosfenelor3. Cu toate acestea, tehnologia ochiului bionic a început abia acum să prindă din urmă. Second Sight a dezvoltat Orion, un sistem care este, potrivit lui Humayun, „practic un Argus II modificat”. La fel ca originalul, acesta folosește o cameră video și un procesor de semnal care comunică fără fir cu un implant, dar cipul este plasat pe suprafața cortexului vizual și nu pe retină. Dispozitivul este testat pe cinci persoane cu o percepție limitată sau inexistentă a luminii din cauza unei leziuni oculare sau a unei deteriorări a retinei sau a nervului optic. „Până acum, rezultatele sunt bune”, spune el. „Încă nu suntem surprinși de nimic.”
Din moment ce o parte din tehnologie este deja încercată și testată pe oameni, Humayun este optimist că sistemul ar putea primi aprobarea de reglementare în câțiva ani. „Evident, chirurgia cerebrală are un alt nivel de risc, dar procedura este destul de simplă, iar Orion ar putea ajuta mult mai mulți pacienți”, spune el. Cu toate acestea, se știe mult mai puțin despre stimularea creierului pentru a oferi o vedere utilă. „Știm multe despre retină, dar foarte puține despre cortex”, spune Botond Roska, neurobiolog la Institutul de Oftalmologie Moleculară și Clinică Basel din Elveția. „Dar nu vom ști niciodată suficient dacă nu încercăm”, spune el.
Terapie genică
Ochiul este o țintă ideală pentru terapia genică. Deoarece este relativ autonom, virușii care sunt folosiți pentru a transporta genele în celulele retinei nu ar trebui să fie capabili să călătorească în alte părți ale corpului. Și pentru că ochiul este un loc imunoprivilegiat, este mai puțin probabil ca sistemul imunitar să organizeze acolo o apărare împotriva unui astfel de virus.
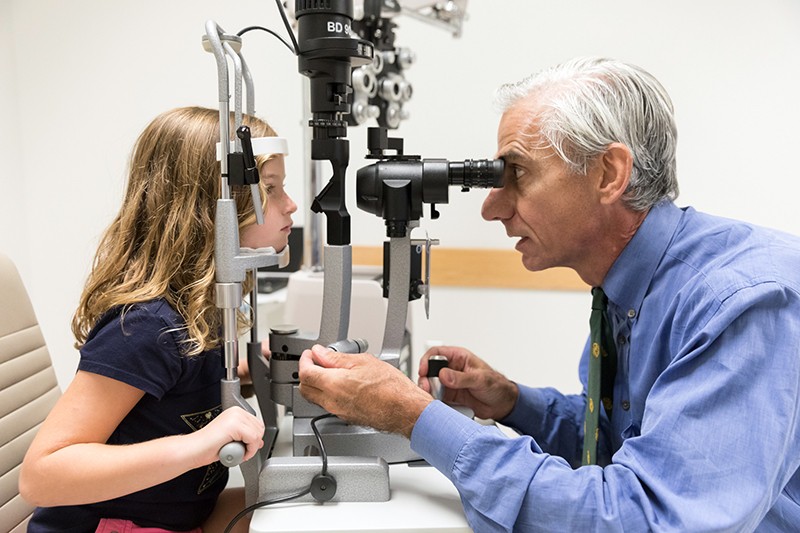
Oftalmologul Albert Maguire examinează ochii unei fetițe cu amauroză congenitală Leber a cărei vedere a fost redată prin terapia genică voretigene neparvovec (Luxturna).Credit: Spitalul de Copii din Philadelphia
În prima demonstrație a potențialului terapiei genice pentru combaterea orbirii, trei echipe de cercetători au folosit tehnica pentru a trata cu succes persoane cu amauroză congenitală Leber (LCA). Această afecțiune ereditară duce la o deficiență vizuală severă și începe în primii câțiva ani de viață, manifestându-se adesea prin orbire nocturnă înainte de a progresa spre o pierdere largă a vederii care începe la periferia câmpului vizual. Afectează aproximativ 1 din 40.000 de copii.
Cercetătorii și-au propus să abordeze o formă specifică a afecțiunii cunoscută sub numele de LCA 2. Aceasta este cauzată de mutații în RPE65, o genă care este exprimată de RPE. Gena mutantă afectează în mod negativ funcția RPE, care, la rândul său, deteriorează celulele fotoreceptoare. În 2008, cele trei echipe, inclusiv una condusă de Hauswirth, au demonstrat fiecare, în cadrul unor studii clinice în fază incipientă, că livrarea unei copii sănătoase a RPE65 în retină a fost sigură și a dus la îmbunătățiri limitate ale vederii4,5,6. Un studiu clinic de fază III condus de Albert Maguire, oftalmolog la Universitatea din Pennsylvania din Philadelphia, a arătat în august 2017 că persoanele cu LCA 2 care au primit tratamentul au fost mai capabile să parcurgă piste cu obstacole la diferite niveluri de iluminare decât cele care nu au primit acest tratament7. În decembrie 2017, FDA a aprobat tratamentul, voretigene neparvovec (Luxturna), făcându-l prima terapie genică pentru orice afecțiune care a primit undă verde pentru utilizare clinică.
Este posibil să se trateze LCA 2 în acest mod deoarece mutațiile genetice implicate prezintă un model recesiv de moștenire. Acest lucru înseamnă că ambele copii ale RPE65 ale unei persoane trebuie să poarte mutațiile relevante pentru a provoca tulburarea. Prin urmare, furnizarea unei singure versiuni nemutate rezolvă problema. Cu toate acestea, afecțiunile care sunt cauzate de mutații cu moștenire dominantă necesită doar o singură copie mutantă a unei gene pentru a se manifesta. În cele mai multe dintre acestea, simpla adăugare a unei copii normale a genei nu va fi de ajutor; în schimb, gena mutantă trebuie să fie inactivată. O opțiune este de a o reduce la tăcere prin adăugarea de molecule specifice de ARN care interceptează instrucțiunile genei mutante pentru producerea proteinei defectuoase și apoi furnizarea unei copii normale a genei pentru a prelua sarcinile acesteia – o abordare denumită suprimare și înlocuire. O altă metodă este de a corecta mutația cu ajutorul tehnicii de editare genetică CRISPR-Cas9. Cercetătorii de la Universitatea din Modena și Reggio Emilia din Modena, Italia, au demonstrat această abordare pe un model de șoarece de retinită pigmentară8 în 2016. În anul următor, o echipă din Statele Unite a utilizat-o pentru a corecta mutația care cauzează un tip de glaucom atât la șoareci, cât și în celule umane cultivate9.
Un motor important al progresului terapiei genice a fost utilizarea virusului adeno-asociat (AAV) pentru a livra gene de înlocuire în celule. S-a demonstrat că AAV-urile sunt sigure, în parte, deoarece au tendința de a nu se integra în genomul celulei gazdă, ceea ce reduce la minimum riscul ca celulele să devină canceroase. De asemenea, dimensiunile lor mici le permit să se răspândească pe scară largă prin ochi și, prin urmare, să infecteze un număr mare de celule. Dar capacitatea AAV-urilor de a transmite gene are limite: unele gene sunt pur și simplu prea mari pentru a fi transportate de AAV-uri, inclusiv ABCA4, ale cărei mutații pot duce la boala Stargardt, o formă ereditară de degenerare maculară. În prezent, se urmăresc două soluții alternative. Prima utilizează un virus cu o capacitate de transport mai mare, cum ar fi un lentivirus, pentru a furniza genele de înlocuire. Siguranța și eficacitatea acestei abordări sunt necunoscute, dar sunt în curs de desfășurare studii clinice. O a doua strategie este de a rupe gena de înlocuire în două și de a transporta fiecare jumătate separat în celulă, împreună cu un mijloc de recombinare a acestora. „Acest lucru funcționează în cel puțin un model animal în acest moment”, spune Hauswirth.
Indiferent de abordare, terapia genică are o limitare considerabilă. Mai mult de 250 de gene sunt implicate în orbire și, deoarece fiecare poate fi afectată de numeroase tipuri de mutații, numărul de potențiale ținte terapeutice este enorm. De exemplu, mai mult de 100 de mutații în gena RHO duc la retinită pigmentară, cea mai frecventă afecțiune a retinei cu transmitere dominantă. Dezvoltarea unei terapii genice pentru fiecare mutație în parte nu este practică, spune Hauswirth.
Cercetătorii lucrează la o soluție potențială care aduce o schimbare față de abordarea de suprimare și înlocuire. În loc să vizeze copiile de RHO care conțin o mutație specifică, ei folosesc un ARN de reducere la tăcere pentru a suprima întreaga expresie a genei, indiferent dacă RHO este mutantă sau nu, furnizând în același timp o copie de înlocuire care este imună la ARN-ul de reducere la tăcere. O echipă condusă de Jane Farrar, genetician la Trinity College, Dublin, a demonstrat în 2011 că această strategie este promițătoare într-un model de șoarece de retinită pigmentară dominantă10. În 2018, Hauswirth și colegii săi au testat această abordare la câini cu retinită pigmentară11. Ei au arătat că degenerarea celulelor fotoreceptoare în zonele tratate ale retinei a putut fi oprită – o îmbunătățire care a persistat timp de cel puțin opt luni. Această strategie abordează toate mutațiile care pot cauza retinita pigmentară cu moștenire dominantă printr-un singur tratament și, prin urmare, extinde terapia genică de la afecțiunile cu moștenire recesivă la cele cu moștenire dominantă „într-un mod destul de simplu”, spune Hauswirth. El intenționează să studieze cât de bine pot naviga pe un labirint câinii care au primit tratamentul și colectează datele de siguranță necesare pentru a începe un studiu clinic.
Optogenetică
Terapia genică funcționează numai la persoanele a căror orbire este cauzată de o mutație genetică. De asemenea, nu este adecvată pentru abordarea bolilor retinei în stadiu terminal, în care rămâne un număr insuficient de celule pentru a fi reparate. Dar o abordare conexă bazată pe o tehnică numită optogenetică este agnostică față de tulburări și ar putea duce la tratamente pentru diferite stadii de degenerare. În optogenetică, genele care permit celulelor să producă proteine sensibile la lumină, cunoscute sub numele de opsine, sunt transmise de un virus. Introducerea opsinelor poate restabili o anumită sensibilitate la lumină a fotoreceptorilor deteriorați sau chiar poate face ca alte celule ale retinei, inclusiv celulele bipolare sau celulele ganglionare retiniene, să devină sensibile la lumină.

Optogenetica a fost folosită pentru a restabili sensibilitatea la lumină a celulelor conice (verde) la un model de șoarece de retinită pigmentară; succesul tehnicii a fost evaluat prin măsurarea activității unei celule ganglionare retiniene (magenta), care este stimulată de conuri ca răspuns la lumină.Credit: IOB.ch
În mod problematic, însă, în timp ce celulele fotoreceptoare din ochi pot face față unei game largi de intensități luminoase – funcționând bine atât în lumina puternică a soarelui, cât și în amurg – opsiunile au o gamă limitată și, adesea, funcționează mai bine la intensități luminoase ridicate. O potențială soluție ar putea fi utilizarea unui sistem care să funcționeze în mod similar cu sistemul de ochi bionic Prima de la Pixium Vision, în care beneficiarii sunt dotați cu ochelari care încorporează o cameră video care captează vederea utilizatorului și un proiector care se îndreaptă spre ochi. Ca și în cazul Prima, avantajul constă în faptul că natura luminii care intră în ochi poate fi adaptată la modificarea retinei; cu toate acestea, în acest caz, intensitatea și lungimea de undă aleasă sunt cele care acționează cel mai bine opsinele nou introduse, mai degrabă decât fotodiodele implantate.
GenSight Biologics, o companie de biotehnologie din Paris care îi numără pe Sahel și Roska printre fondatorii săi, testează deja un astfel de sistem. Acesta își propune să livreze o opsină către celulele ganglionare ale retinei, dar există o potențială piedică: celulele ganglionare ale retinei sunt sensibile în mod natural la lumină. Ele exprimă melanopsina, o proteină implicată în reflexul pupilar de lumină, în care pupila ochiului se contractă ca răspuns la lumina puternică. Pentru a evita declanșarea acestui fenomen, cercetătorii de la GenSight folosesc o opsină care răspunde la lungimea de undă roșie a luminii, deoarece melanopsina răspunde în mod preferențial la lumina de la capătul albastru al spectrului. Compania a început un studiu clinic în fază incipientă în octombrie 2018 la persoanele cu retinită pigmentară avansată care mai au o vedere minimă. Studiul va implica cohorte din Regatul Unit, Franța și Statele Unite, iar rezultatele inițiale sunt așteptate până la sfârșitul anului 2020.
„Aceasta este o abordare simplă și va trebui să vedem ce se va obține”, spune Roska. „Apoi, putem trece la abordări din ce în ce mai sofisticate”. O problemă care rămâne este că multe dintre tulburările pe care tehnicile optogenetice le-ar putea trata implică degenerarea unor părți specifice ale retinei, viziunea utilă fiind păstrată în alte zone. Lumina care acționează opsinele este vizibilă și ar putea interfera cu vederea naturală rămasă. În viitor, opsinele care răspund la lumina în infraroșu apropiat ar putea permite tratamentelor optogenetice să funcționeze în tandem cu vederea naturală reziduală.
Regenerare celulară
Terapia cu celule stem ar putea, potențial, să vindece orbirea chiar și în stadiile tardive ale bolii. Deoarece celulele stem pot fi convinse să devină orice tip de celulă, acestea ar putea fi folosite pentru a crește celule retiniene proaspete pentru a fi transplantate în ochi pentru a le înlocui pe cele care au fost pierdute. Cu toate acestea, studiile efectuate pe animale au arătat că doar o mică parte dintre neuronii transplantați sunt capabili să se integreze corect în circuitul neuronal complex al retinei. Acesta este un obstacol considerabil pentru tratamentele cu celule stem care au ca scop înlocuirea neuronilor din retină.

Structura celulară complexă a retinei include straturi de fotoreceptori (verde) și vase de sânge și nervi (magenta).Credit: Louise Hughes/SPL
Celulele care alcătuiesc epiteliul pigmentar retinian, pe de altă parte, se află în afara circuitelor retinei. Prin urmare, terapiile pe bază de celule stem sunt cele mai promițătoare pentru afecțiuni, cum ar fi AMD și retinita pigmentară, care determină degenerarea celulelor RPE. „Fotoreceptorii trebuie să se conecteze la circuite, dar epiteliul pigmentar retinian nu”, spune Roska. „Acesta este locul în care oamenii sunt cel mai aproape de a face progrese”. Inițial, cercetătorii au încercat să injecteze în retină celule RPE derivate din celule stem în suspensie, dar prea puține au rămas acolo unde era nevoie de ele. Mai multe echipe sunt acum de părere că o abordare mai bună este de a transplanta celulele RPE în ochi sub forma unei foi preformate care este apoi menținută în poziție de o schelă biocompatibilă. „Abordarea cu scheletul este o îmbunătățire uriașă, în comparație cu suspensia, pentru celulele RPE”, spune Sahel.
În martie 2018, London Project to Cure Blindness – o colaborare între University College London și Moorfields Eye Hospital din Londra – a anunțat rezultatele unui studiu de fază I în care o foaie de celule RPE a fost implantată în retina a două persoane cu AMD umedă (o formă rară și gravă de AMD care implică o creștere anormală și scurgeri de vase de sânge). Ambii beneficiari au tolerat bine procedura și au reușit să citească cu 21-29 de litere mai mult pe o diagramă de citire decât înainte de tratament12. În luna următoare, o echipă condusă de Humayun a raportat rezultate similare în faza I la cinci persoane cu AMD uscată, forma mai frecventă a acestei afecțiuni13. Aceste rezultate inițiale sunt pline de promisiuni. „Acest lucru a dus la o mulțime de entuziasm”, spune Humayun. Dar constatările trebuie să fie confirmate prin studii de fază III pe un număr mai mare de participanți, iar Humayun avertizează că tratamentul ar putea fi la mulți ani distanță de utilizarea în clinică, deoarece nicio terapie cu celule stem pentru o afecțiune a retinei nu a reușit încă să treacă de procesul de aprobare.
O abordare conexă, aflată încă în stadii incipiente de cercetare fundamentală, ar putea împlini speranța de a înlocui neuronii pierduți, deschizând ușa tratamentelor pentru o mare varietate de boli oculare. La om, neuronii maturi nu se divid și, prin urmare, nu se pot regenera, ceea ce face ca restabilirea vederii să fie deosebit de dificilă. Dar nu același lucru este valabil pentru toate animalele. Reptilele și anumiți pești pot regenera neuronii retinieni, iar păsările prezintă, de asemenea, o anumită capacitate de regenerare. Thomas Reh, cercetător în neuroștiințe la Universitatea Washington din Seattle, încearcă să deblocheze această capacitate la om. Dar, mai degrabă decât să transplanteze celule cultivate în laborator, Reh urmărește să convingă celulele care se află deja în retină să se diferențieze în neuroni proaspeți.
În 2001, Reh a sugerat că glia Müller – celule care asigură structura retinei și îi susțin funcția – este sursa noilor neuroni care au fost observați la pești și păsări14. El și echipa sa s-au apucat apoi să afle dacă glia Müller ar putea fi folosită pentru a genera neuroni proaspeți la șoareci. În 2015, ei au modificat șoareci pentru a produce Ascl1, o proteină care este importantă pentru producerea de neuroni la pești, și apoi au afectat retina animalelor15. Speranța lor era ca Ascl1 să provoace glia Müller să se transforme în neuroni.
Experimentul nu a reușit să producă neuroni noi la șoarecii adulți, dar a reușit la șoarecii tineri. Nikolas Jorstad, biochimist și doctorand în echipa lui Rehs, a propus că modificările chimice aduse cromatinei (un complex de ADN, ARN și proteine) în nucleul celular în timpul dezvoltării ar putea bloca accesul în celulele mature la genele care permit glia Müller să se transforme în neuroni. În august 2017, echipa lui Reh a arătat că, prin introducerea unei enzime care inversează astfel de modificări, ar putea convinge glia Müller să se diferențieze16. „Pentru prima dată, am putut regenera neuroni la șoarecele adult”, spune Reh. „După toți acești ani, am fost destul de încântat”. Deși nu erau adevărate celule fotoreceptoare și arătau mai degrabă ca niște celule bipolare, neuronii se conectau la circuitele existente și erau sensibili la lumină. „Am fost surprins că se conectează atât de bine precum o fac”, spune Reh.
Chiar dacă este departe de a fi gata să trateze tulburările retiniene la oameni, lucrarea are un potențial uriaș. Următorul pas va fi repetarea studiilor pe animale cu ochi care sunt mai asemănători cu cei ai oamenilor. Echipa lui Reh lucrează deja cu culturi de celule retiniene de la primate non-umane. De asemenea, cercetătorii trebuie să afle cum să direcționeze procesul de diferențiere pentru a produce tipuri specifice de celule, cum ar fi bastonașe și conuri. „Acum că am pus piciorul în afacerea de fabricare a neuronilor, conurile ar fi grozav”, spune Reh.
Dacă va avea succes, abordarea ar putea fi aplicabilă la scară largă. „În cele din urmă, acesta va fi modul în care vor fi tratate toate aceste boli oculare”, prezice Reh. „Este pur și simplu logic. Nu trebuie să vă faceți griji cu privire la efectuarea corectă a transplanturilor. Celulele tale sunt chiar acolo unde ai nevoie de ele.”
Humayun este, de asemenea, încurajat de această lucrare. „Încurajez pe oricine are o nouă idee bună”, spune el. „Este foarte devreme, este un risc ridicat, dar niciodată să nu spui niciodată. Asta este ceea ce am învățat.”
.