THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
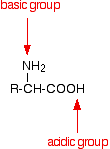
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Se dissolver o aminoácido em água, uma solução simples também contém este íon.
A zwitterion é um composto sem carga elétrica total, mas que contém partes separadas que estão carregadas positiva e negativamente.
Adicionando um álcali a uma solução de aminoácido
Se você aumentar o pH de uma solução de um aminoácido pela adição de íons hidróxidos, o íon hidrogênio é removido do grupo -NH3+.
![]()

Você poderia mostrar que o aminoácido agora existia como um íon negativo usando eletroforese.
Na sua forma mais simples, a eletroforese pode consistir apenas em um pedaço de papel filtro umedecido em uma lâmina de microscópio com um clipe de crocodilo em cada extremidade preso a uma bateria. Uma gota de solução de aminoácidos é colocada no centro do papel.
Embora a solução de aminoácidos seja incolor, a sua posição após algum tempo pode ser encontrada pulverizando-a com uma solução de ninidrina. Se o papel secar e depois for aquecido suavemente, o aminoácido aparece como uma mancha colorida.
O aminoácido seria encontrado para viajar em direcção ao ânodo (o eléctrodo positivo).
Adicionando um ácido a uma solução de aminoácido
Se você diminuir o pH adicionando um ácido a uma solução de um aminoácido, a parte -COO- do zwitterion pega um íon de hidrogênio.
![]()
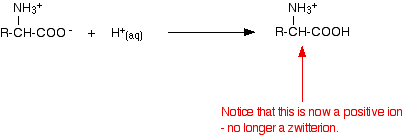
Desta vez, durante a electroforese, o aminoácido mover-se-ia em direcção ao cátodo (o eléctrodo negativo).
Mudando o pH de um extremo para o outro
Se você começar com o íon que acabamos de produzir sob condições ácidas e lentamente adicionar-lhe álcali.
Que o íon contém dois hidrogênios ácidos – o do grupo -COOH e o do grupo -NH3+.
O mais ácido destes é o do grupo -COOH, e assim é removido primeiro – e você volta para o zwitterion.
![]()
![]()
Então quando você adicionou a quantidade certa de álcali, o aminoácido não tem mais uma carga líquida positiva ou negativa. Isso significa que ele não se moveria para o cátodo ou anodo durante a eletroforese.
O pH em que essa falta de movimento durante a eletroforese acontece é conhecido como o ponto isoelétrico do aminoácido. Este pH varia de aminoácido para aminoácido.
Se você continuar adicionando íons hidróxidos, você terá a reação que já vimos, na qual um íon hidrogênio é removido do grupo -NH3+.
![]()
![]()