1) Úvod
Srdeční výtokový trakt (OFT) je přechodná struktura na arteriálním pólu srdce spojující embryonální komory s aortálním vakem. OFT vzniká během kličkování srdce ze srdečních progenitorových buněk ve faryngeálním mezodermu. Při svém maximálním rozšíření je OFT torzní myokardiální válec vystlaný endokardiálními buňkami s ortogonálními, ale přiléhajícími proximálními (konálními) a distálními (kmenovými) oblastmi. OFT se následně přetváří současně s komorovou septací, během níž se stěna OFT otáčí a dělí a vytváří základ vzestupné aorty a plicního kmene. Remodelace OFT je spojena s tvorbou výtokového septa, morfogenezí semilunární chlopně, koronární arteriogenezí a zráním myokardiální a hladké svalové složky báze velkých tepen. Genetické nebo environmentální narušení prodlužování a remodelace OFT vede ke konotrunálním vrozeným srdečním vadám, které představují 30 % všech vrozených srdečních vad (přibližně 0,3 % živě narozených dětí) (Bruneau, 2008; Srivastava a Olson, 2000). Rozsáhlé anatomické, experimentální a genetické studie morfogeneze OFT odhalily zapojení více typů buněk a signálních drah do vývoje OFT, což naznačuje, že vývojová složitost stojí za zvýšeným výskytem anomálií OFT u člověka.
2) Tvorba OFT
Během prodlužování srdeční trubice se k arteriálnímu pólu srdce postupně přidává myokard z populace progenitorových buněk ve faryngeálním mezodermu označované jako druhé srdeční pole (SHF; obrázek 1A) (Buckingham et al., 2005; Kelly a Buckingham, 2002), (Cai et al., 2003). SHF je umístěno v mezodermu mediálně, ale sousedí s buňkami, které dávají vzniknout časné srdeční trubici; následně buňky SHF podkládají ventrální endoderm předního střeva a tvoří dorzální stěnu perikardiální dutiny. Kromě žilního pólu a AV oblasti srdce se SHF podílí na tvorbě pravé komory; populace progenitorových buněk, které se podílejí výhradně na tvorbě arteriálního pólu, se nazývá přední nebo sekundární srdeční pole. Byly identifikovány kritické transkripční regulátory vývoje SHF, mezi něž patří transkripční faktory Isl1, Foxh1, Tbx1, Pitx2 a Mef2c (přehled v (Buckingham et al., 2005)). Mezi klíčové vlastnosti SHF patří její mediální poloha, zpoždění diferenciace a zvýšená proliferace ve srovnání s buňkami, které dávají vzniknout časné srdeční trubici. Tyto vlastnosti jsou regulovány jak vnitřně, tak okolními CNC buňkami a faryngeálním ektodermem a endodermem prostřednictvím aktivity signálních molekul fibroblastového růstového faktoru, kostního morfogenetického proteinu, Hedgehog a Wnt dráhy (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Tyto signály společně definují niku udržující progenitorové buňky SHF a regulují jejich postupné nasazení během rozšiřování OFT (Rochais et al., 2009). OFT je vystlán endokardiálními buňkami, o nichž se rovněž předpokládá, že pocházejí z faryngeálního mezodermu (Laugwitz et al., 2008).
Během prodlužování srdeční trubice se k arteriálnímu pólu srdce postupně přidává myokard z populace progenitorových buněk ve faryngeálním mezodermu označované jako druhé srdeční pole (SHF; obr. 1A) (Buckingham et al., 2005; Kelly a Buckingham, 2002), (Cai et al., 2003). SHF je umístěno v mezodermu mediálně, ale sousedí s buňkami, které dávají vzniknout časné srdeční trubici; následně buňky SHF podkládají ventrální endoderm předního střeva a tvoří dorzální stěnu perikardiální dutiny. Kromě žilního pólu a AV oblasti srdce se SHF podílí na tvorbě pravé komory; populace progenitorových buněk, které se podílejí výhradně na tvorbě arteriálního pólu, se nazývá přední nebo sekundární srdeční pole. Byly identifikovány kritické transkripční regulátory vývoje SHF, mezi něž patří transkripční faktory Isl1, Foxh1, Tbx1, Pitx2 a Mef2c (přehled v (Buckingham et al., 2005)). Mezi klíčové vlastnosti SHF patří její mediální poloha, zpoždění diferenciace a zvýšená proliferace ve srovnání s buňkami, které dávají vzniknout časné srdeční trubici. Tyto vlastnosti jsou regulovány jak vnitřně, tak okolními CNC buňkami a faryngeálním ektodermem a endodermem prostřednictvím aktivity signálních molekul fibroblastového růstového faktoru, kostního morfogenetického proteinu, Hedgehog a Wnt dráhy (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Tyto signály společně definují niku udržující progenitorové buňky SHF a regulují jejich postupné nasazení během rozšiřování OFT (Rochais et al., 2009). OFT je vystlán endokardiálními buňkami, o nichž se rovněž předpokládá, že pocházejí z faryngeálního mezodermu (Laugwitz et al., 2008).
Během tvorby OFT je arteriální pól srdce posunut kaudálně v oblasti faryngu, protože probíhá morfogeneze faryngeálního oblouku a tvorba bilaterálních arterií aortálního oblouku (Waldo et al., 2005b). Buňky CNC, odvozené z dorzální neurální trubice, migrují přes kaudální faryngeální oblouky do OFT srdce během formování distální oblasti OFT (obrázek 1B) (Hutson a Kirby, 2003). Kromě kritické úlohy při remodelaci OFT hrají CNC buňky časnou roli při omezování proliferace a kontrole rozmístění SHF (Waldo et al., 2005a). Jak CNC buňky vstupují do distálního OFT, endotelové buňky v proximální oblasti OFT procházejí procesem přechodu z epitelu na mezenchym v reakci na signály pocházející z myokardu, aby společně s invadujícími buňkami neurálního hřebene vytvořily OFT polštáře mezi myokardiální a endotelovou vrstvou (Sugishita et al., 2004b). Konvergence OFT polštářů ve spirální struktuře odděluje laminární proudění z embryonální levé a pravé komory. Vývoj polštářů závisí na mnoha mezibuněčných signálních drahách včetně transformujícího růstového faktoru b, fibroblastového růstového faktoru, kostního morpogenetického proteinu, VEGF, Notch a nekanonické Wnt signalizace (Wagner a Siddiqui, 2007). OFT dosahuje své maximální délky v polovině gestace u myši (E10,5) nebo ve 4. týdnu vývoje u člověka.
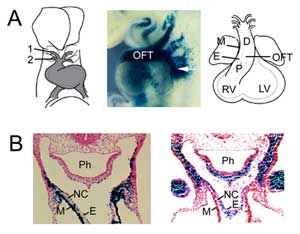
Obrázek 1
Tvorba OFT. (A) OFT v 8,5. embryonálním dni myši je spojen s první (1) a druhou (2) arterií aortálního oblouku (vlevo) a rozšiřuje se přidáním progenitorových buněk druhého srdečního pole z faryngeálního mezodermu (uprostřed, šipka), vizualizováno pomocí transgenu Fgf10 enhancer trap v E9,5. OFT dosahuje maximální délky v 10,5. embryonálním dni myši a skládá se z proximální (P) a distální (D) oblasti. (B) Srovnání exprese transgenu Fgf10 v OFT a druhém srdečním poli (vlevo) s buňkami odvozenými od nervového hřebene (vpravo) v distálním OFT v E9.5. Pravý panel reprodukován z Jiang et al., 2001, Development 127:1607-16, se svolením. M, myokard; E, endokard; RV, pravá komora; LV, levá komora; Ph, hltan; NC, buňky odvozené od neurálního hřebene.
3) Remodelace OFT
Během remodelace OFT získává levá komora nezávislý vývod, vzestupnou aortu, která poskytuje kritický systémový kanál pro okysličenou krev při narození. Válcovitý OFT se přeměňuje v základ vzestupné aorty a plicního kmene (vývod pravé komory) současně s atrioventrikulární septací a remodelací arterie aortálního oblouku mezi 10,5. a 14,5. dnem březosti myší. Remodelace OFT je komplexní proces, na němž se podílí jak genetika, tak hemodynamika (Yashiro et al., 2007). Kritická role vývoje polštáře OFT a CNC buněk v tomto procesu je prokázána (Sugishita et al., 2004b). Proximální myokard OFT se začleňuje do komorového vývodu a proces invazivní myokardializace vede k muskularizaci proximálního vývodového septa (Rana et al., 2007; van den Hoff et al., 2001). Prorůstání aorto-pulmonálního septa mezi 4. a 6. arterií aortálního oblouku odděluje distální OFT na vzestupnou aortu a plicní kmen (obr. 2A). Hladké svalové stěny se vyvíjejí na bázi velkých tepen z konečného příspěvku druhého srdečního pole a distálněji z CNC (Sugishita et al., 2004b; Waldo et al., 2005b).
Septaci OFT doprovází rotace stěny OFT v protisměru hodinových ručiček, což vede k zarovnání aorty s levou komorou a plicního kmene s pravou komorou (Bajolle et al., 2006). Tento proces septace je ukončen sblížením OFT, atrioventrikulárního a komorového septa (obrázek 2A). Původní distální stěna myokardu OFT zčásti přispívá k subpulmonálnímu myokardu pravé komory a zčásti podléhá během ventrikuloarteriálního vyrovnání programované buněčné smrti způsobené hypoxií (Rana et al., 2007; Sugishita et al., 2004a). Během procesu remodelace vznikají na úhlovém spojení proximální a distální oblasti OFT z původního a dvou interkalárních polštářů OFT semilunární chlopně (Anderson et al., 2003). Koronární arteriogeneze je proces, při kterém epikardiálně odvozený koronární plexus selektivně zasahuje do báze aorty nad dvěma chlopenními lístky směřujícími k plicnímu kmeni a vytváří ostie spojující koronární systém se vzestupnou aortou (obr. 2B) (Tománek, 2005).
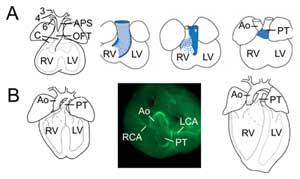
Obrázek 2.
Přeměna výtokového traktu. (A) V embryonálním dni 11,5 je OFT napojen na třetí (3), čtvrtou (4) a šestou (6) tepnu aortálního oblouku (vlevo). Aorto-pulmonální septum (APS) odděluje distální OFT na vzestupnou aortu (Ao) a plicní kmen (PT) sbíhající se s polštáři OFT (C). Tři snímky vpravo ukazují postupnou rotaci stěny myokardu během septace OFT: z dorzální stěny v embryonálním dni 10,5 (modrá) vzniká ventrální subpulmonální myokard. (B) V embryonálním dni 14,5 je septace OFT dokončena a aorta je spojena s levou komorou a plicní kmen s pravou komorou. Při pohledu shora (uprostřed) odhaluje imunochemie hladkého svalového aktinu napojení levé (LCA) a pravé (RCA) koronární tepny na základnu aorty. Struktura definitivního srdce (vpravo). RV, pravá komora; LV, levá komora.
4) Vrozené srdeční vady konotrunální
Základní vývojová složitost vývoje OFT se odráží ve vysokém výskytu konotrunálních anomálií u člověka (Bruneau, 2008; Srivastava a Olson, 2000). Selhání nasazení SHF nebo CNC nebo remodelace OFT přispívají ke spektru konotrunálních vad pozorovaných v lidské patologii a na zvířecích modelech (obrázek 3) (Moon, 2008).
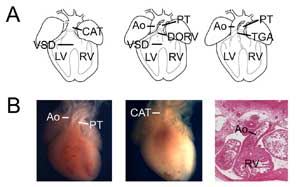
Obrázek 3.
Vrozené srdeční vady. (A) Karikatury zobrazující společný arteriální kmen (neboli perzistující truncus arteriosus, CAT, vlevo), dvojitou výtokovou pravou komoru (DORV, uprostřed) a transpozici velkých tepen (TGA, vpravo). VSD, defekt komorového septa; RV, pravá komora; LV, levá komora, Ao, aorta; PT, plicní kmen. (B) Příklady myších modelů vrozených srdečních vad. Kontrolní srdce zobrazující aortu a plicní kmen (vlevo) ve srovnání se srdcem s nulovým Tbx1 (uprostřed) s jedním komorovým vývodem (CAT). Příklad transpozičního typu s dvojitým vývodem pravé komory ukazující aortu spojenou s pravou komorou u Tbx3 nulového srdce (vpravo).
Zatímco těžká porucha vývoje SHF vede k selhání prodlužování srdeční trubice, mírnější defekty mají za následek anomálie ventrikuloarteriálního uspořádání a neschopnost aorty vytvořit nezávislé spojení s levou komorou (Abu-Issa a Kirby, 2007). Tyto defekty mohou být vlastní SHF nebo ovlivňovat okolní typy buněk (CNC nebo hltanové epitelie), které kontrolují niku progenitorových buněk SHF. Tyto defekty mohou mít za následek dvojvýtok pravé komory, převýšení aorty, hypoplazii plicnice, atrézii plicnice a Fallotovu tetralogii. Ztráta nebo redukce CNC vede k selhání nebo opoždění septace OFT, což má za následek přetrvávající truncus arteriosus nebo dvojitou výtokovou pravou komoru; nedostatek CNC také nepřímo ovlivňuje vývoj SHF, což vede ke složenému fenotypu uspořádání a septace (Hutson a Kirby, 2003). Porucha rotace stěny OFT při remodelaci OFT má rovněž za následek defekty zarovnání včetně transpozice velkých tepen, dvojité výtokové pravé komory a přecházející aorty, které běžně následují po defektech embryonální laterality (Bajolle et al., 2006; Bamforth et al., 2001). Defekty v tvorbě septa OFT mohou být také důsledkem pozdějšího selhání diferenciace stěny myokardu a anomálií v procesech nezbytných pro remodelaci, jako je programovaná buněčná smrt nebo myokardializace (Park et al., 2008). Bylo také prokázáno, že vnitřní defekty endokardiálních buněk OFT, stejně jako hemodynamické změny, vedou k anomáliím OFT 16, (Zhang et al., 2009), (Bartman a Hove, 2005; Yashiro et al., 2007). A konečně, abnormální proximální uspořádání koronárních tepen je často spojeno s konotrunálními defekty a samostatně je významnou příčinou náhlé srdeční smrti (Angelini et al., 2002). Mezi současné výzkumné cíle patří lepší pochopení etiologie konotrunálních defektů prostřednictvím identifikace příčinných genetických mutací a modifikátorů pomocí genomového screeningu a rozbor relativního podílu genetických a epigenetických hráčů na tvorbě a remodelaci OFT pomocí zvířecích modelů. Tyto studie umožní nahlédnout do signálních drah a buněčných procesů, které řídí morfogenezi OFT a jsou cílem mechanismů onemocnění.