
Transmutation ist der Akt der Umwandlung einer materiellen oder immateriellen Substanz von einer Form oder einem Zustand in einen anderen. Für die Alchemisten der Antike bedeutete dies die Umwandlung einer physischen Substanz in eine andere, insbesondere von unedlen Metallen wie Blei in wertvolles Silber und Gold. Für die modernen Wissenschaftler bedeutet dies die Umwandlung eines Elements in ein anderes durch einen oder eine Reihe von Kernzerfällen oder Reaktionen.
Obwohl die Menschen in der Antike mit Gold, Silber, Kupfer, Eisen, Zinn, Blei, Kohlenstoff, Schwefel und Quecksilber arbeiteten, hatten sie nur wenig Ahnung von Chemie und konnten wenig darüber schreiben. Zu dieser Zeit war die Chemie eine Kunst, keine Wissenschaft. Die Ägypter waren die ersten, die zu Beginn der christlichen Ära umfangreiche schriftliche Aufzeichnungen über chemische Verfahren anfertigten, und Ägypten wird allgemein als die Wiege der Chemie angesehen. Aus diesen Schriften geht hervor, dass die Entwicklung von Methoden zur Umwandlung einer Substanz in eine andere eines der wichtigsten frühen Ziele ihrer Untersuchungen war. In den mehreren hundert Jahren, die auf diese Schriften folgten, versuchten die Alchemisten, durch verschiedene chemische Manipulationen von Mischungen und Destillationen Verfahren zu entwickeln, um unedle Metalle in Gold und Silber umzuwandeln. Die Alchemisten wurden durch scheinbare Erfolge angespornt – so konnten sie beispielsweise mit ihren chemischen Verfahren sehr geringe Mengen Gold aus Bleierz gewinnen. (Dieses Gold war zweifellos in Spuren in den ursprünglichen Erzen vorhanden und wurde nicht durch Transmutation gewonnen.) Die eigentliche Torheit der Alchemisten zeigte sich im Mittelalter bei der Suche nach dem Stein der Weisen, einer Substanz, die mit unedlen Metallen vermischt und durch Reinigung in Gold verwandelt werden konnte. Er wurde nie gefunden.
Da jedes Element eine unterschiedliche, aber festgelegte Anzahl von Protonen im Atomkern hat, nämlich die Ordnungszahl, muss bei der Umwandlung eines chemischen Elements in ein anderes diese Zahl geändert werden. Für eine solche Kernreaktion ist millionenfach mehr Energie erforderlich, als durch chemische Reaktionen zur Verfügung steht. Daher war der Traum des Alchemisten, Blei in Gold zu verwandeln, chemisch nie realisierbar.
Obwohl es den Alchemisten nicht gelang, eine Methode zur Umwandlung von unedlen Metallen in Edelmetalle zu finden, resultierten aus ihren Bemühungen eine Reihe wichtiger chemischer Prozesse. So extrahierten sie beispielsweise Metalle aus Erzen, stellten eine Reihe anorganischer Säuren und Basen her, die später kommerzielle Bedeutung erlangten, und entwickelten die Techniken des Schmelzens, Kalzinierens, Lösens, Filtrierens, Kristallisierens, Sublimierens und vor allem des Destillierens. Im Mittelalter versuchten sie, die Ergebnisse ihrer primitiven Experimente und ihre Informationsfragmente zu systematisieren, um chemische Reaktionen zwischen Substanzen zu erklären oder vorherzusagen. So entstanden die Idee der chemischen Elemente und die ersten primitiven Formen des chemischen Periodensystems.
Ironischerweise fanden Kerntransmutationen praktisch vor den Augen der Alchemisten (oder unter ihren Füßen) statt, aber sie hatten weder die Methoden, diese Vorgänge zu erkennen, noch das Wissen, sie zu nutzen. Die Entdeckung der Kerntransmutation war eng mit der Entdeckung der Radioaktivität durch Henri Becquerel im Jahr 1896 verbunden. Kerntransmutationen treten beim spontanen radioaktiven Zerfall von natürlich vorkommendem Thorium und Uran (Ordnungszahl 90 bzw. 92) und der radioaktiven

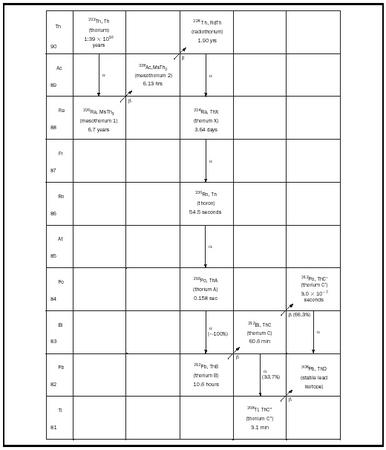
Tochterprodukte ihres Zerfalls, nämlich die natürlichen Zerfallsreihen. Als Beispiel ist in Abbildung 1 die Zerfallsreihe von 232 Th dargestellt. Die hochgestellte Zahl 232 steht für die Atommasse, d. h. die Gesamtzahl der Protonen und Neutronen im Kern des Atoms. In dieser Zerfallsreihe beginnt ein 232 Th-Kern den Prozess mit der spontanen Emission eines α-Teilchens (ein He-Kern mit zwei Protonen und zwei Neutronen). Durch diese Reaktion wird der Th-Kern in einen Kern mit zwei Protonen und zwei Neutronen weniger, nämlich 228 Ra, umgewandelt. Dann gibt der 228 Ra-Kern spontan ein β-Teilchen (ein Elektron) ab, das ein Neutron des Kerns in ein Proton umwandelt, wodurch sich die Ordnungszahl des entstandenen Kerns um eins erhöht, ohne dass sich die Atommasse ändert, was 228 Ac ergibt. Diese Abfolge von aufeinanderfolgenden α- und β-Zerfällen setzt sich von einem Element zum anderen fort, bis der stabile Kern 208 Pb entsteht (siehe Abbildung 1). Es gibt noch zwei weitere natürlich vorkommende Zerfallsketten, eine beginnend mit 235 U (die Actinium-Serie) und eine beginnend mit 238 U (die Uran-Serie). Neben diesen drei Zerfallsreihen gibt es in der Natur noch vierzehn weitere radioaktive Isotope im Bereich von 40 K bis 190 Pt, die sich durch Zerfall in stabile Elemente umwandeln.
Die Idee der Transmutation von Elementen in den natürlichen Zerfallsketten ging nicht mit der Entdeckung der Radioaktivität durch Becquerel einher. Marie und Pierre Curie erweiterten jedoch die Untersuchungen von Becquerel mit einer Vielzahl von
U-Mineralien und stellten fest, dass die radioaktiven Eigenschaften nicht von den physikalischen oder chemischen Formen des Urans abhängen, sondern von den Eigenschaften des Elements selbst. Mit Hilfe chemischer Trennungsmethoden isolierten sie 1898 zwei neue radioaktive Substanzen, die mit den U-Mineralen verbunden waren, und nannten sie Polonium und Radium. 1902 erklärten Ernest Rutherford und Frederick Soddy die Art des Prozesses, der in den natürlichen Zerfallsketten als radioaktive Zerfälle von U und Th auftritt, um neue Substanzen durch Transmutation zu erzeugen.
Lord Rutherford und seine Gruppe von Wissenschaftlern waren 1919 die ersten, die künstliche Kerntransmutationen erzeugten und nachwiesen. Er beschoss Stickstoff in der Luft mit den α-Teilchen, die beim Zerfall von 214 Po entstehen. Bei der Transmutationsreaktion wurde ein α-Teilchen von den 14 N-Kernen absorbiert, wodurch 17 O und ein Proton (ein Wasserstoffkern) entstanden. Diese Reaktion lässt sich wie folgt beschreiben:
14 N + 4 He → 17 O + 1 H
Lord Rutherford konnte die in dieser Kernreaktion erzeugten Protonen nachweisen und identifizieren und damit den Transmutationsprozess demonstrieren.
Bis 1934 standen nur natürlich vorkommende radioaktive Elemente zur Untersuchung zur Verfügung. Doch im Januar desselben Jahres berichteten Irene Curie (Tochter von Marie Curie) und Frederic Joliot, dass Bor- und Aluminiumproben durch Beschuss mit α-Teilchen aus Polonium radioaktiv gemacht werden konnten, wobei die beiden neuen radioaktiven Produkte 13 N bzw. 30 P entstanden. Diese Entdeckung begründete die neuen Gebiete der Nuklearchemie und Radiochemie und löste deren rasche Entwicklung aus.
Mit der Entwicklung von Kernreaktoren und Beschleunigern für geladene Teilchen (gemeinhin als „Atomsmashers“ bezeichnet) in der zweiten Hälfte des zwanzigsten Jahrhunderts wurde die Transmutation von einem Element in ein anderes alltäglich. Tatsächlich wurden etwa zwei Dutzend synthetische Elemente mit höheren Ordnungszahlen als das natürlich vorkommende Uran durch nukleare Transmutationsreaktionen hergestellt. Es ist also prinzipiell möglich, den Traum des Alchimisten zu verwirklichen, Blei in Gold zu verwandeln, aber die Kosten für die Herstellung durch nukleare Transmutationsreaktionen würden den Wert des Goldes bei weitem übersteigen.