1) Introduzione
Il tratto di efflusso cardiaco (OFT) è una struttura transitoria al polo arterioso del cuore che collega i ventricoli embrionali con il sacco aortico. L’OFT si forma durante il looping del cuore da cellule progenitrici cardiache nel mesoderma faringeo. Alla sua massima estensione l’OFT è un cilindro miocardico in torsione rivestito di cellule endocardiche, con domini prossimali (conali) e distali (troncali) ortogonali ma contigui. L’OFT viene successivamente rimodellato, in concomitanza con il settaggio ventricolare, durante il quale il processo la parete OFT ruota e si divide per generare la base dell’aorta ascendente e del tronco polmonare. Il rimodellamento dell’OFT è associato alla formazione di un setto di uscita, alla morfogenesi della valvola semilunare, all’arteriogenesi coronarica e alla maturazione delle componenti miocardiche e muscolari lisce della base delle grandi arterie. La perturbazione genetica o ambientale dell’allungamento e del rimodellamento dell’OFT porta a difetti cardiaci congeniti conotrurali, che rappresentano il 30% di tutti i difetti cardiaci congeniti (circa 0,3% dei nati vivi) (Bruneau, 2008; Srivastava e Olson, 2000). Ampi studi anatomici, sperimentali e genetici sulla morfogenesi dell’OFT hanno rivelato il coinvolgimento di molteplici tipi di cellule e vie di segnalazione nello sviluppo dell’OFT, suggerendo che la complessità dello sviluppo è alla base dell’elevata incidenza di anomalie OFT nell’uomo.
2) Formazione dell’OFT
Durante l’allungamento del tubo cardiaco, il miocardio viene progressivamente aggiunto al polo arterioso del cuore da una popolazione di cellule progenitrici nel mesoderma faringeo chiamata secondo campo cardiaco (SHF; Figura 1A) (Buckingham et al, 2005; Kelly e Buckingham, 2002), (Cai et al., 2003). Il SHF è posizionato nel mesoderma mediale ma contiguo alle cellule che danno origine al tubo cardiaco precoce; successivamente le cellule SHF sottendono l’endoderma ventrale del foregut, costituendo la parete dorsale della cavità pericardica. L’SHF contribuisce al ventricolo destro oltre al polo venoso e alle regioni AV del cuore; quella popolazione di cellule progenitrici che contribuisce esclusivamente al polo arterioso è nota come campo cardiaco anteriore o secondario. I regolatori trascrizionali critici dello sviluppo della SHF sono stati identificati e comprendono i fattori di trascrizione Isl1, Foxh1, Tbx1, Pitx2 e Mef2c (rivisto in (Buckingham et al., 2005)). Le proprietà chiave della SHF includono la sua posizione mediale, il ritardo di differenziazione e l’elevata proliferazione rispetto alle cellule che danno origine al primo tubo cardiaco. Queste proprietà sono regolate sia intrinsecamente che dalle cellule CNC circostanti e dall’ectoderma ed endoderma faringeo attraverso l’attività delle molecole di segnalazione del fattore di crescita dei fibroblasti, della proteina morfogenetica ossea, delle vie Hedgehog e Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Insieme questi segnali definiscono la nicchia mantenendo le cellule progenitrici SHF e regolando il loro progressivo dispiegamento durante l’estensione OFT (Rochais et al., 2009). L’OFT è rivestito da cellule endocardiche che si pensa derivino anche dal mesoderma faringeo (Laugwitz et al., 2008).
Durante l’allungamento del tubo cardiaco, il miocardio viene progressivamente aggiunto al polo arterioso del cuore da una popolazione di cellule progenitrici nel mesoderma faringeo chiamata secondo campo cardiaco (SHF; Figura 1A) (Buckingham et al., 2005; Kelly e Buckingham, 2002), (Cai et al., 2003). Il SHF è posizionato nel mesoderma mediale ma contiguo alle cellule che danno origine al tubo cardiaco precoce; successivamente le cellule SHF sottendono l’endoderma ventrale del foregut, costituendo la parete dorsale della cavità pericardica. L’SHF contribuisce al ventricolo destro oltre al polo venoso e alle regioni AV del cuore; quella popolazione di cellule progenitrici che contribuisce esclusivamente al polo arterioso è nota come campo cardiaco anteriore o secondario. I regolatori trascrizionali critici dello sviluppo della SHF sono stati identificati e comprendono i fattori di trascrizione Isl1, Foxh1, Tbx1, Pitx2 e Mef2c (rivisto in (Buckingham et al., 2005)). Le proprietà chiave della SHF includono la sua posizione mediale, il ritardo di differenziazione e l’elevata proliferazione rispetto alle cellule che danno origine al primo tubo cardiaco. Queste proprietà sono regolate sia intrinsecamente che dalle cellule CNC circostanti e dall’ectoderma ed endoderma faringeo attraverso l’attività delle molecole di segnalazione del fattore di crescita dei fibroblasti, della proteina morfogenetica ossea, delle vie Hedgehog e Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Insieme questi segnali definiscono la nicchia mantenendo le cellule progenitrici SHF e regolando il loro progressivo dispiegamento durante l’estensione OFT (Rochais et al., 2009). L’OFT è rivestito da cellule endocardiche che si pensa derivino anche dal mesoderma faringeo (Laugwitz et al., 2008).
Durante la formazione dell’OFT il polo arterioso del cuore è spostato caudalmente nella regione faringea mentre avviene la morfogenesi dell’arco faringeo e la formazione delle arterie bilaterali dell’arco aortico (Waldo et al., 2005b). Le cellule CNC, derivate dal tubo neurale dorsale, migrano attraverso gli archi faringei caudali nell’OFT del cuore durante la formazione della regione distale dell’OFT (Figura 1B) (Hutson e Kirby, 2003). Oltre ad un ruolo critico nel rimodellamento dell’OFT, le cellule CNC svolgono un ruolo precoce nel limitare la proliferazione e nel controllare il dispiegamento della SHF (Waldo et al., 2005a). Quando le cellule CNC entrano nell’OFT distale, le cellule endoteliali nella regione prossimale dell’OFT subiscono un processo di transizione da epiteliale a mesenchimale in risposta ai segnali derivati dal miocardio, per formare, insieme alle cellule della cresta neurale invadenti, dei cuscini OFT tra gli strati miocardici ed endoteliali (Sugishita et al., 2004b). La convergenza dei cuscini OFT in una struttura a spirale separa il flusso laminare dai ventricoli destro e sinistro embrionali. Lo sviluppo dei cuscini dipende da molteplici vie di segnalazione intercellulari tra cui il fattore di crescita b trasformante, il fattore di crescita dei fibroblasti, la proteina morpogenetica ossea, il VEGF, Notch e la segnalazione Wnt non canonica (Wagner e Siddiqui, 2007). L’OFT raggiunge la sua lunghezza massima a metà gestazione nel topo (E10.5) o alla quarta settimana di sviluppo nell’uomo.
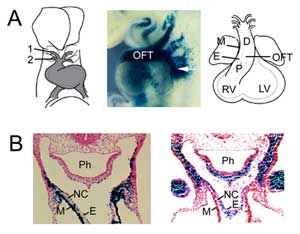
Figura 1
Formazione OFT. (A) L’OFT al giorno embrionale del topo 8.5 è collegato alla prima (1) e seconda (2) arterie dell’arco aortico (a sinistra) e si estende per aggiunta di cellule progenitrici del secondo campo cardiaco dal mesoderma faringeo (centro, freccia), visualizzato con un transgene Fgf10 enhancer trap a E9.5. L’OFT raggiunge la lunghezza massima al giorno embrionale del mouse 10.5 ed è composto da prossimale (P) e distale (D) regioni. (B) Confronto tra l’espressione del transgene Fgf10 nel OFT e secondo campo del cuore (a sinistra) con cellule derivate dalla cresta neurale (a destra) nel OFT distale a E9.5. Pannello di destra riprodotto da Jiang et al., 2001, Development 127:1607-16, con permesso. M, miocardio; E, endocardio; RV, ventricolo destro; LV, ventricolo sinistro; Ph, faringe; NC, cellule derivate dalla cresta neurale.
3) Rimodellamento dell’OFT
Durante il rimodellamento dell’OFT il ventricolo sinistro acquisisce uno sbocco indipendente, l’aorta ascendente, fornendo un condotto sistemico critico per il sangue ossigenato alla nascita. L’OFT cilindrico si trasforma nella base dell’aorta ascendente e del tronco polmonare (sbocco del ventricolo destro) in concomitanza con il setto atrioventricolare e il rimodellamento dell’arteria aortica tra i giorni 10.5 e 14.5 della gestazione del topo. Il rimodellamento OFT è un processo complesso con contributi sia genetici che emodinamici (Yashiro et al., 2007). I ruoli critici dello sviluppo del cuscino OFT e delle cellule CNC in questo processo sono stabiliti (Sugishita et al., 2004b). Il miocardio OFT prossimale è incorporato nello sbocco ventricolare e un processo di miocardio invasivo porta alla muscolarizzazione del setto di sbocco prossimale (Rana et al., 2007; van den Hoff et al., 2001). La crescita del setto aortico-polmonare tra la quarta e la sesta arteria dell’arco aortico separa l’OFT distale nell’aorta ascendente e nel tronco polmonare (Figura 2A). Le pareti muscolari lisce si sviluppano alla base delle grandi arterie dal contributo finale del secondo campo cardiaco e più distalmente dai CNC (Sugishita et al., 2004b; Waldo et al., 2005b).
Il settaggio dell’OFT è accompagnato dalla rotazione della parete dell’OFT in senso antiorario con conseguente allineamento dell’aorta al ventricolo sinistro e del tronco polmonare al ventricolo destro (Bajolle et al., 2006). Questo processo di settaggio è completato dalla convergenza dei setti OFT, atrioventricolare e ventricolare (Figura 2A). La parete miocardica OFT distale originale in parte contribuisce al miocardio ventricolare destro subpolmonare e in parte subisce la morte cellulare programmata guidata dall’ipossia durante l’allineamento ventricoloarterioso (Rana et al., 2007; Sugishita et al., 2004a). Durante il processo di rimodellamento, le valvole semilunari si formano alla giunzione angolare delle regioni prossimali e distali dell’OFT dall’originale e da due cuscinetti OFT intercalati (Anderson et al., 2003). L’arteriogenesi coronarica è il processo attraverso il quale il plesso coronarico di derivazione epicardica invade selettivamente la base dell’aorta sopra i due foglietti valvolari rivolti verso il tronco polmonare, formando ostia che collegano il sistema coronarico con l’aorta ascendente (Figura 2B) (Tomanek, 2005).
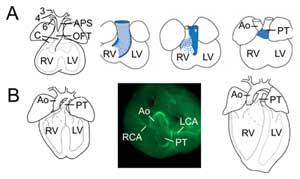
Figura 2.
Rimodellamento del tratto di efflusso. (A) Al giorno embrionale 11,5 l’OFT è collegato alla terza (3), quarta (4) e sesta (6) arteria dell’arco aortico (a sinistra). Il setto aortico-polmonare (APS) separa l’OFT distale nell’aorta ascendente (Ao) e nel tronco polmonare (PT) che convergono con i cuscinetti OFT (C). Le tre immagini di destra mostrano la rotazione progressiva della parete miocardica durante il settaggio OFT: la parete dorsale al giorno embrionale 10.5 (blu) dà origine al miocardio ventrale subpolmonare. (B) Al giorno embrionale 14,5 il settaggio OFT è completo e l’aorta è collegata al ventricolo sinistro e il tronco polmonare al ventricolo destro. In una vista superiore (al centro) l’immunochimica dell’actina muscolare liscia rivela le connessioni delle arterie coronarie sinistra (LCA) e destra (RCA) alla base dell’aorta. Struttura del cuore definitivo (a destra). RV, ventricolo destro; LV, ventricolo sinistro.
4) Difetti cardiaci congeniti conotruncal
La complessità dello sviluppo dell’OFT si riflette nell’alta incidenza di anomalie conotruncal nell’uomo (Bruneau, 2008; Srivastava e Olson, 2000). Il fallimento del dispiegamento di SHF o CNC o del rimodellamento OFT contribuiscono allo spettro dei difetti conotruncal osservati nella patologia umana e nei modelli animali (Figura 3) (Moon, 2008).
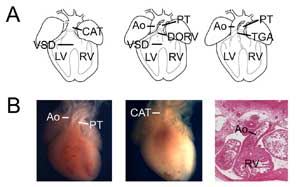
Figura 3.
Difetti cardiaci congeniti. (A) vignette che mostrano il tronco arterioso comune (o tronco arterioso persistente, CAT, a sinistra), il ventricolo destro a doppia uscita (DORV, al centro) e la trasposizione delle grandi arterie (TGA, a destra). VSD, difetto del setto ventricolare; RV, ventricolo destro; LV, ventricolo sinistro, Ao, aorta; PT, tronco polmonare. (B) Esempi di modelli murini di difetti cardiaci congeniti. Cuore di controllo che mostra l’aorta e il tronco polmonare (a sinistra) rispetto a un cuore nullo Tbx1 (al centro) con un singolo sbocco ventricolare (CAT). Esempio di un ventricolo destro a doppia uscita di tipo trasposizione che mostra l’aorta collegata al ventricolo destro in un cuore nullo Tbx3 (destra).
Mentre una grave compromissione dello sviluppo del SHF porta al fallimento dell’allungamento del tubo cardiaco, difetti più lievi risultano in anomalie di allineamento ventricoloarterioso e nel fallimento dell’aorta di stabilire una connessione indipendente con il ventricolo sinistro (Abu-Issa e Kirby, 2007). Questi difetti possono essere intrinseci alla SHF o interessare tipi di cellule circostanti (CNC o epiteli faringei) che controllano la nicchia delle cellule progenitrici SHF. Tali difetti possono provocare un ventricolo destro a doppia uscita, un’aorta che si sovrappone, ipoplasia polmonare, atresia polmonare e tetralogia di Fallot. La perdita o la riduzione del CNC porta al fallimento o al ritardo del settaggio dell’OFT con conseguente persistenza del tronco arterioso o del ventricolo destro a doppia uscita; la carenza del CNC influenza anche indirettamente lo sviluppo della SHF con conseguente fenotipo composito di allineamento e settaggio (Hutson e Kirby, 2003). Il fallimento della rotazione della parete OFT durante il rimodellamento OFT si traduce anche in difetti di allineamento tra cui la trasposizione delle grandi arterie, doppio ventricolo destro di uscita e l’aorta overriding, comunemente successivo a difetti nella lateralità embrionale (Bajolle et al., 2006; Bamforth et al., 2001). Difetti nella formazione del setto OFT possono anche derivare da un successivo fallimento della differenziazione della parete miocardica e da anomalie nei processi essenziali per il rimodellamento come la morte cellulare programmata o la miocardizzazione (Park et al., 2008). Difetti intrinseci nelle cellule endocardiche OFT, così come i cambiamenti emodinamici, hanno anche dimostrato di portare ad anomalie OFT 16, (Zhang et al., 2009), (Bartman e Hove, 2005; Yashiro et al., 2007). Infine, anormale patterning coronarica prossimale è frequentemente associato con difetti conotruncal e, in isolamento, è una causa significativa di morte cardiaca improvvisa (Angelini et al., 2002). Tra gli attuali obiettivi di ricerca sono una migliore comprensione dell’eziologia dei difetti conotruncal attraverso l’identificazione di mutazioni genetiche causali e modificatori da schermi genoma wide e la dissezione del contributo relativo dei giocatori genetici ed epigenetici nella formazione OFT e rimodellamento utilizzando modelli animali. Questi studi forniranno approfondimenti sulle vie di segnalazione e sui processi cellulari che guidano la morfogenesi dell’OFT e sono gli obiettivi dei meccanismi di malattia.