1) Inleiding
Het cardiale uitstroomtraject (OFT) is een voorbijgaande structuur aan de arteriële pool van het hart die de embryonale ventrikels met de aorta verbindt. De OFT vormt zich tijdens de hartlus uit cardiale progenitorcellen in het faryngeale mesoderm. In zijn maximale uitrekking is de OFT een gedraaide myocardiale cilinder bekleed met endocardiale cellen, met orthogonale maar aaneengesloten proximale (conale) en distale (truncale) domeinen. De OFT wordt vervolgens geremodelleerd, gelijktijdig met de ventriculaire septatie, tijdens welk proces de OFT-wand roteert en zich verdeelt om de basis van de opstijgende aorta en de longstam te vormen. De remodellering van het OFT gaat gepaard met de vorming van een uitlaatseptum, morfogenese van de semilunaire klep, coronaire arteriogenese en maturatie van de myocardiale en gladde spiercomponenten van de basis van de grote arteriën. Genetische of omgevingsstoornissen van OFT-verlenging en -remodellering leiden tot conotruncale congenitale hartafwijkingen, die 30% van alle congenitale hartafwijkingen uitmaken (ongeveer 0,3% van alle levendgeborenen) (Bruneau, 2008; Srivastava en Olson, 2000). Uitgebreide anatomische, experimentele en genetische studies van OFT morfogenese hebben de betrokkenheid van meerdere celtypes en signaalwegen in OFT ontwikkeling aangetoond, wat suggereert dat ontwikkelingscomplexiteit ten grondslag ligt aan de verhoogde incidentie van OFT afwijkingen bij de mens.
2) OFT-vorming
Tijdens de verlenging van de hartbuis wordt geleidelijk myocardium toegevoegd aan de arteriële pool van het hart vanuit een progenitorcelpopulatie in het faryngeale mesoderm, dat het tweede hartveld (SHF; figuur 1A) wordt genoemd (Buckingham et al, 2005; Kelly en Buckingham, 2002), (Cai et al., 2003). De SHF is gepositioneerd in het mesoderm mediaal, maar grenst aan cellen die aanleiding geven tot de vroege hartbuis, vervolgens SHF cellen onderliggend ventrale voordarm endoderm, die de dorsale wand van de pericardiale holte. Het SHF draagt bij tot het rechter ventrikel naast de veneuze pool en AV regio’s van het hart; de populatie van progenitorcellen die uitsluitend bijdragen tot de arteriële pool staat bekend als het anterieure of secundaire hartveld. Kritische transcriptionele regulatoren van de SHF ontwikkeling zijn geïdentificeerd en omvatten de transcriptionele factoren Isl1, Foxh1, Tbx1, Pitx2 en Mef2c (besproken in (Buckingham et al., 2005)). Belangrijke eigenschappen van de SHF zijn de mediale positie, de uitgestelde differentiatie en de verhoogde proliferatie ten opzichte van cellen die aan de basis liggen van de vroege hartbuis. Deze eigenschappen worden zowel intrinsiek als door de omliggende CNC cellen en faryngeaal ectoderm en endoderm gereguleerd via de activiteit van signaalmoleculen van de fibroblast groeifactor, bot morfogenetisch eiwit, Hedgehog en Wnt pathways (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Samen bepalen deze signalen de niche die de SHF progenitorcellen in stand houdt en hun geleidelijke ontplooiing regelt tijdens de OFT uitbreiding (Rochais et al., 2009). De OFT wordt bekleed door endocardiale cellen ook verondersteld af te leiden van faryngeale mesoderm (Laugwitz et al., 2008).
Tijdens de verlenging van de hartbuis, wordt myocard geleidelijk toegevoegd aan de arteriële pool van het hart van een progenitor celpopulatie in faryngeale mesoderm aangeduid als het tweede hart veld (SHF; Figuur 1A) (Buckingham et al., 2005; Kelly en Buckingham, 2002), (Cai et al., 2003). De SHF is gepositioneerd in het mesoderm mediaal, maar grenst aan cellen die aanleiding geven tot de vroege hartbuis, vervolgens SHF cellen onderliggend ventrale voordarm endoderm, die de dorsale wand van de pericardiale holte. Het SHF draagt bij tot het rechter ventrikel naast de veneuze pool en AV regio’s van het hart; de populatie van progenitorcellen die uitsluitend bijdragen tot de arteriële pool staat bekend als het anterieure of secundaire hartveld. Kritische transcriptionele regulatoren van de SHF ontwikkeling zijn geïdentificeerd en omvatten de transcriptionele factoren Isl1, Foxh1, Tbx1, Pitx2 en Mef2c (besproken in (Buckingham et al., 2005)). Belangrijke eigenschappen van het SHF zijn de mediale positie, de uitgestelde differentiatie en de verhoogde proliferatie ten opzichte van cellen die aan de basis liggen van de vroege hartbuis. Deze eigenschappen worden zowel intrinsiek als door de omliggende CNC cellen en faryngeaal ectoderm en endoderm gereguleerd via de activiteit van signaalmoleculen van de fibroblast groeifactor, bot morfogenetisch eiwit, Hedgehog en Wnt pathways (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Samen bepalen deze signalen de niche die de SHF progenitorcellen in stand houdt en hun geleidelijke ontplooiing regelt tijdens de OFT uitbreiding (Rochais et al., 2009). De OFT wordt bekleed door endocardiale cellen waarvan ook gedacht wordt dat ze afkomstig zijn van faryngeale mesoderm (Laugwitz et al., 2008).
Tijdens OFT vorming wordt de arteriële pool van het hart caudaal verplaatst in de faryngeale regio als faryngeale boog morfogenese en de vorming van bilaterale aortaboog slagaders plaatsvindt (Waldo et al., 2005b). CNC cellen, afkomstig uit de dorsale neurale buis, migreren door de caudale faryngeale bogen in de OFT van het hart tijdens de vorming van het distale gebied van de OFT (figuur 1B) (Hutson en Kirby, 2003). Naast een kritische rol in OFT remodellering, CNC cellen spelen een vroege rol in het beperken van de proliferatie en de controle van de inzet van de SHF (Waldo et al., 2005a). Als CNC cellen de distale OFT binnengaan, ondergaan endotheelcellen in de proximale regio van de OFT een proces van epitheliale naar mesenchymale transitie in reactie op signalen afkomstig van het myocard, om samen met binnendringende neurale lijst cellen, OFT kussens te vormen tussen de myocardiale en endotheel lagen (Sugishita et al., 2004b). Convergentie van OFT kussens in een spiraalvormige structuur scheidt laminaire stroming van de embryonale linker en rechter ventrikels. De ontwikkeling van de kussens is afhankelijk van meerdere intercellulaire signaalwegen waaronder transformerende groeifactor b, fibroblast groeifactor, bot morpogenetisch eiwit, VEGF, Notch en niet-kanonieke Wnt signalering (Wagner en Siddiqui, 2007). De OFT bereikt zijn maximale lengte bij midgestatie bij de muis (E10,5) of de 4e week van ontwikkeling bij de mens.
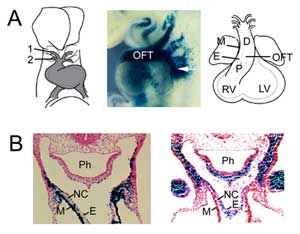
Figuur 1
OFT-vorming. (A) De OFT bij muis embryonale dag 8,5 is verbonden met de eerste (1) en tweede (2) aortaboog slagaders (links) en breidt zich uit door toevoeging van tweede hartveld progenitorcellen van faryngeale mesoderm (midden, pijl), gevisualiseerd met een Fgf10 enhancer trap transgen bij E9,5. De OFT bereikt maximale lengte op de muis embryonale dag 10,5 en is samengesteld uit proximale (P) en distale (D) regio’s. (B) Vergelijking van Fgf10 transgene expressie in de OFT en tweede hart veld (links) met neurale lijst afgeleide cellen (rechts) in de distale OFT op E9.5. Rechter paneel gereproduceerd uit Jiang et al., 2001, Development 127:1607-16, met toestemming. M, myocardium; E, endocardium; RV, rechter ventrikel; LV, linker ventrikel; Ph, farynx; NC, van de neurale lijst afgeleide cellen.
3) OFT-remodellering
Tijdens OFT-remodellering krijgt de linker ventrikel een onafhankelijke uitgang, de aorta ascendens, die een kritisch systemisch kanaal vormt voor zuurstofrijk bloed bij de geboorte. De cilindrische OFT wordt omgezet in de basis van de aorta ascendens en pulmonale stam (uitlaat van de rechter ventrikel) gelijktijdig met atrioventriculaire septatie en aortaboog slagader remodellering tussen dagen 10,5 en 14,5 van de muis zwangerschap. OFT remodellering is een complex proces met bijdragen van zowel de genetica als de hemodynamica (Yashiro et al., 2007). De kritische rol van OFT kussen ontwikkeling en CNC cellen in dit proces zijn vastgesteld (Sugishita et al., 2004b). Proximaal OFT myocard wordt geïncorporeerd in de ventriculaire outlet en een proces van invasieve myocardialisatie leidt tot muscularisatie van het proximale outlet septum (Rana et al., 2007; van den Hoff et al., 2001). Ingroei van het aorticopulmonale septum tussen de 4e en 6e aortaboogslagaders scheidt de distale OFT in de ascenderende aorta en de pulmonale stam (figuur 2A). Gladde gespierde wanden ontwikkelen zich aan de basis van de grote slagaders van de laatste bijdrage van het tweede hart veld en meer distaal van CNCs (Sugishita et al., 2004b; Waldo et al., 2005b).
OFT septatie gaat gepaard met rotatie van de OFT wand in een linksdraaiende richting resulteert in uitlijning van de aorta met de linker ventrikel en pulmonale stam met de rechter ventrikel (Bajolle et al., 2006). Dit septatie proces wordt voltooid door convergentie van de OFT, atrioventriculaire en ventriculaire septa (Figuur 2A). De oorspronkelijke distale OFT myocardiale wand voor een deel bijdraagt tot rechts ventriculaire subpulmonale myocard en voor een deel ondergaat hypoxie-gedreven geprogrammeerde celdood tijdens ventriculoarterial uitlijning (Rana et al., 2007; Sugishita et al., 2004a). Tijdens het remodelleringsproces vormen zich semilunaire kleppen op de hoekige kruising van de proximale en distale regio’s van de OFT van de oorspronkelijke en twee geïntercaleerde OFT-kussens (Anderson et al., 2003). Coronaire arteriogenese is het proces waarbij de epicardiaal-afgeleide coronaire plexus selectief binnenvalt de basis van de aorta boven de twee klepbladen geconfronteerd met de pulmonale stam, de vorming van ostia het aansluiten van de coronaire systeem met de opgaande aorta (Figuur 2B) (Tomanek, 2005).
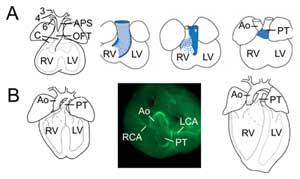
Figuur 2.
Outflow tract remodelling. (A) Op embryonale dag 11,5 is de OFT verbonden met de derde (3), vierde (4) en zesde (6) aortaboogslagaders (links). Het aorticopulmonale septum (APS) scheidt de distale OFT in de klimmende aorta (Ao) en pulmonale stam (PT) convergerende met OFT kussens (C). De rechter drie beelden tonen progressieve rotatie van de myocardiale wand tijdens OFT septatie: de dorsale wand op embryonale dag 10,5 (blauw) geeft aanleiding tot ventrale subpulmonale myocardium. (B) Op embryonale dag 14,5 is de OFT-septatie voltooid en is de aorta verbonden met de linker ventrikel en de pulmonale stam met de rechter ventrikel. In een superieure weergave (midden) gladde spier actine immunochemie onthult de verbindingen van de linker (LCA) en rechter (RCA) kransslagaders aan de basis van de aorta. Structuur van het definitieve hart (rechts). RV, rechter ventrikel; LV, linker ventrikel.
4) Conotruncal congenitale hartafwijkingen
De onderliggende complexiteit van de ontwikkeling van OFT wordt weerspiegeld in de hoge incidentie van conotruncal afwijkingen bij de mens (Bruneau, 2008; Srivastava en Olson, 2000). Falen van SHF of CNC ontplooiing of van OFT remodellering dragen bij aan het spectrum van conotruncal defecten waargenomen in de menselijke pathologie en diermodellen (figuur 3) (Moon, 2008).
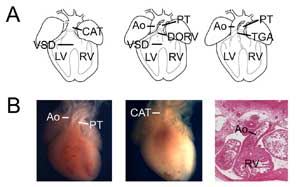
Figuur 3.
Aangeboren hartafwijkingen. (A) Cartoons met de gemeenschappelijke arteriële truncus (of persisterende truncus arteriosus, CAT, links), double outlet rechter ventrikel (DORV, midden) en transpositie van de grote arteriën (TGA, rechts). VSD, ventrikelseptumdefect; RV, rechter ventrikel; LV, linker ventrikel, Ao, aorta; PT, longstam. (B) Voorbeelden van muismodellen van aangeboren hartafwijkingen. Controle hart met de aorta en de pulmonale stam (links) in vergelijking met een Tbx1 null hart (midden) met een enkele ventriculaire uitlaat (CAT). Voorbeeld van een transpositie-type dubbele uitlaat rechter ventrikel toont de aorta verbonden met de rechter ventrikel in een Tbx3 nolledig hart (rechts).
Een ernstige stoornis in de ontwikkeling van de SHF leidt tot het mislukken van de verlenging van de hartbuis, terwijl mildere afwijkingen resulteren in ventriculoarteriële uitlijningsafwijkingen en het falen van de aorta om een onafhankelijke verbinding met de linker ventrikel tot stand te brengen (Abu-Issa en Kirby, 2007). Deze defecten kunnen intrinsiek zijn aan de SHF of invloed hebben op de omliggende celtypes (CNC of faryngeale epithelia) die de SHF progenitorcel niche controleren. Dergelijke defecten kunnen resulteren in een double outlet rechter ventrikel, een overriding aorta, pulmonale hypoplasie, pulmonale atresie en tetralogie van Fallot. Verlies of reductie van de CNC leidt tot falen of vertraging van OFT septatie resulterend in persisterende truncus arteriosus of dubbele uitlaat rechterventrikel; CNC deficiëntie beïnvloedt ook indirect de SHF ontwikkeling resulterend in een samengestelde uitlijning en septatie fenotype (Hutson en Kirby, 2003). Het falen van de rotatie van de OFT wand tijdens OFT remodellering resulteert ook in uitlijningsafwijkingen, waaronder transpositie van de grote slagaders, double outlet rechter ventrikel en overriding aorta, meestal als gevolg van defecten in embryonale lateraliteit (Bajolle et al., 2006; Bamforth et al., 2001). Defecten in de vorming van het OFT-septum kunnen ook het gevolg zijn van latere mislukking van myocardiale wanddifferentiatie en afwijkingen in processen die essentieel zijn voor remodellering, zoals geprogrammeerde celdood of myocardialisatie (Park et al., 2008). Intrinsieke defecten in OFT endocardiale cellen, evenals hemodynamische veranderingen, zijn ook aangetoond om te leiden tot OFT anomalieën 16, (Zhang et al., 2009), (Bartman and Hove, 2005; Yashiro et al., 2007). Tenslotte wordt abnormale proximale coronaire arteriepatroon vaak geassocieerd met conotruncal defecten en, op zichzelf, is een belangrijke oorzaak van plotselinge hartdood (Angelini et al., 2002). Een van de huidige onderzoeksdoelstellingen is een beter begrip van de etiologie van conotruncale defecten door de identificatie van oorzakelijke genetische mutaties en modificatoren door genoomwijde screeningen en de ontleding van de relatieve bijdrage van genetische en epigenetische spelers in OFT vorming en remodellering met behulp van diermodellen. Deze studies zullen inzicht verschaffen in de signaalwegen en cellulaire processen die de morfogenese van de OFT aansturen en het doelwit zijn van ziektemechanismen.