Daratumumab (DARA) is een geneesmiddel dat onlangs door de FDA werd goedgekeurd en door Janssen werd gepatenteerd voor de behandeling van multipel myeloom. Dit geneesmiddel is een lgG1k CD38-gericht monoklonaal antilichaam (MoAb) dat tot expressie komt in myeloomcellen; het is zeer cytotoxisch voor de tumorcellen in deze patiënten.1-4 De aanwezigheid van CD38-antigeen op de oppervlakken van de erytrocyten van gezonde personen is ook aangetoond met flowcytometrie.5 Bovendien is bij routine compatibiliteitstests panreactiviteit vastgesteld in het plasma van patiënten die met DARA zijn behandeld.6 Dit is een nieuw probleem in de transfusiegeneeskunde dat de tijdige levering van bloedbestanddelen vertraagt en daardoor een potentieel gevaar voor het leven van de patiënt betekent. Aangezien het een recent onderwerp betreft, is in de technische procedurehandleidingen (d.w.z. de AABB) geen specifieke methodologie opgenomen om dit soort problemen op te lossen.
Al meer dan 20 jaar worden rode bloedcellen die met het redox-agens dithiothreitol (DDT) zijn behandeld, algemeen gebruikt om het Kell-antigeen te denatureren, evenals andere minder klinisch significante antigeengroepen als gevolg van een hemolytische transfusiereactie. We kunnen dit zien zoals in de gevallen van Landsteiner-Wiener, Cartwright, Dombrock, Indian, Jhon Milton Hagen, Lutheran en Raph. Dit kenmerk is nuttig bij het onderzoek naar allo-antilichamen (technische handleiding van de AABB).7,8
Meer recent is aangetoond dat het CD38 antigeen ook gevoelig is voor denaturering door het redox-agens dithiothreitol (DDT),9 zonder de rest van de klinisch belangrijke erytrocytenantigenen aan te tasten. Van de mogelijkheden om de interferentie uit te roeien, passen wij de DTT-techniek toe, die ons in staat stelt de aanwezigheid van klinisch significante antilichamen op te sporen en aldus bloedbestanddelen te leveren met een lager transfusierisico voor de patiënt.
Materialen en methoden
De bloedbank van het Zambrano Hellion-ziekenhuis ontving een transfusieaanvraag van 2 eenheden bolvormige pakketten en 4 trombocytenconcentraten. De patiënt, een 64-jarige man zonder transfusies in zijn achtergrond, had een diagnose van multipel myeloom met een evolutie van 4 jaar en was resistent tegen conventionele medische behandeling. Veneus bloed werd afgenomen met EDTA. De monsters werden onderzocht voor routine pre-transfusietests door middel van de conventionele methoden en technieken die in de bloedbank worden gebruikt (d.w.z. micro-agglutinatietechnieken in gel). ABO-bloedgroeponderzoek en Rh werden uitgevoerd met Grifols-kaarten.
Voor het opsporen en identificeren van onregelmatige antilichamen werd gebruik gemaakt van een volledig Grifols erytrocytenpanel, alsmede van Grifols DG Gel Coombs-kolommen. Bovendien werden de pre-transfusie cross-matching tests verwerkt volgens de techniek beschreven in de DG Coombs insert (antihumaan globuline poly-specifiek), voor de behandeling van erytrocyten met dithiothreitol (DTT) bij 0,2M, pH 8, met behulp van de 4.6-methode van het technisch handboek van de ABB (12e editie van de algemene laboratoriummethoden)8 (zie fig. 1).
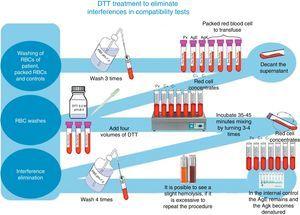
DTT-behandeling om interferenties in compatibiliteitstests te elimineren.
Resultaten
Het plasma van de patiënt vertoonde panreactiviteit met het panel erytrocyten en bekende antigenen, die homogeen een reactiepatroon met een 3+ intensiteit (graad 0-4) vertoonden (zie Fig.
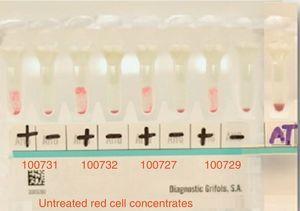 Hoofdkruisvergelijkingstest met 4 donors resulteerde in incompatibiliteit. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
Hoofdkruisvergelijkingstest met 4 donors resulteerde in incompatibiliteit. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
Main cross matching test with 4 donors resulted in incompatibility. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
The main cross-matching test resulted in incompatibility with all studied donors (15 in total).
The patient’s erythrocytes presented a negative direct anti-human globulin test (IgG and C3b), as well as a negative control. The presence of hemolysis in the patient’s sample was not detected (see Fig. 3).

Results direct anti-human globulin test (IgG and C3b) presenting negative results.
Op het moment dat we tests uitvoerden met het plasma van de patiënt en de erytrocyten die eerder waren behandeld met DTT van de verschillende donoren, evenals met de erytrocyten die werden gebruikt in het antilichaamscreeningspanel, hebben we in geen van de bestudeerde monsters reactiviteit gevonden. K+ en E+ controle erytrocyten werden gebruikt om te verifiëren dat DTT alleen het K antigeen denatureerde en het E antigeen behield; dit was een onderdeel van de kwaliteitscontrole van onze studie om vast te stellen dat andere antigenen gerelateerd aan klinisch significante antilichamen inactief waren (zie Fig. 4).

Antibody screening panel erytrocyten DTT threated, met negatieve resultaten bij 4 bloeddonors. C1 (controle positief) C2 (controle negatief).
Discussie
Het gebruik van anti-CD38 is een veelbelovende behandeling voor patiënten met multipel myeloom en wordt momenteel bestudeerd voor andere soorten kwaadaardige gezwellen. Het probleem is dat deze medicatie interfereert met de compatibiliteitstests, waardoor tijdige en veilige levering van bloedcomponenten wordt bemoeilijkt.
Er zijn aanwijzingen dat de anti-CD38 in het serum van patiënten die met DARA worden behandeld, binden met het CD38-antigeen dat tot expressie komt in de erytrocyten die worden gebruikt in het antilichaamtraceerpanel, alsmede in de donors van de pre-transfusie cross-matching test, waardoor een panreactiviteit wordt gegenereerd. Dit kan de aanwezigheid van klinisch significante antilichamen maskeren, vooral bij multiparae patiënten of bij polygetransfundeerde patiënten. Deze panreactiviteit kan worden omgekeerd door het gebruik van neutraliserende agentia, die de onregelmatige identificatie van antilichamen en de opsporingstests herstellen. Anti-idiotype antilichamen, evenals oplosbare recombinant CD38, zijn in eerdere artikelen met positieve resultaten geëvalueerd.
Van de beschikbare mogelijkheden om deze storing in de bloedbank op te heffen, hebben wij de DDT-techniek gebruikt. Zijn beste eigenschap is het feit dat het een redox-agent is die de tertiaire structuur van het eiwit onderbreekt door disulfideverbindingen onomkeerbaar te reduceren tot vrije sulfhydryl. Zonder tertiaire structuur kunnen de antigenen, die eiwitten bevatten, niet langer antilichamen fixeren, waardoor de serologische reactiviteit wordt geremd. Een potentieel probleem met deze techniek is dat zij ook andere bloedgroepantigenen aantast. In de dagelijkse praktijk is echter alleen het K-antigeen klinisch van belang. Daarom wordt aanbevolen om patiënten die met DARA worden behandeld alleen te transfuseren met K-erytrocytenconcentraten. De mogelijkheid van verlies van reactiviteit op andere agentia zoals K en Yta is eveneens aanwezig. Dit blijkt echter een uiterst zeldzame gebeurtenis te zijn. DDT deactiveert niet de serologische activiteit van de meeste klinisch belangrijke en frequente antigenen zoals Rh, Duffy, Kidd en MNS systemen. Het is verstandig om het fenotype of genotype van de patiënt te bepalen alvorens een behandeling met DARA te beginnen.
In de Immunohematologie maakt men zich zorgen over de mogelijke toename van dit type interferentie bij routine bloedtransfusietests, die kan ontstaan als gevolg van nieuwe monoklonale antilichaamtherapieën bij patiënten met kanker.
Concluderend heeft onze studie aangetoond dat de behandeling van erytrocyten met DTT het CD38 antigeen inactiveert, waardoor de reactiviteit met het serum van de met DARA behandelde patiënt wordt opgeheven. Deze eenvoudige en praktische methode maakt het mogelijk studies uit te voeren zonder de interferentie die de aanwezigheid van alloantilichamen kan veroorzaken in transfusiereacties bij patiënten die een therapie krijgen op basis van dit monoklonale antilichaam.
Het probleem van panreactiviteit dat interferentie veroorzaakt in de compatibiliteitstests van patiënten die met DARA worden behandeld, kan technisch worden opgelost met de behandeling van erytrocyten met DTT van potentiële bloeddonoren. Dit middel deactiveert het in deze cellen aanwezige CD38-antigeen. Deze panreactiviteit mag geen vertraging opleveren voor de levering van bloedproducten, die in noodsituaties gebruik zullen maken van identieke ABO globulaire pakketten en Rh compatibele rode bloedcellen, overeenkomstig de praktijken van de bloedbank. Dit noopt tot het opstellen van aanbevelingen en/of gidsen voor de behandelende artsen en het personeel van de bloedbanken die dit soort patiënten verzorgen. Het is belangrijk te bedenken dat tot op heden geen hemolytische transfusiereacties zijn waargenomen bij de ongeveer 2000 patiënten die met DARA zijn behandeld.8 Bij recent onderzoek naar de veiligheid van transfusie bij patiënten die met DARA zijn behandeld en die ongeveer 76.000 cycli van toepassing van het geneesmiddel hebben ondergaan, is geen enkele bijwerking van transfusiehemolyse gevonden.10-12
Het gezamenlijke werk van de onco-hematoloog en de bloedbank moet aanwezig zijn vanaf het moment dat patiënten in het ziekenhuis worden opgenomen. De procedures voor transfusie die op dit soort patiënten worden toegepast, moeten de identificatie van het volledige erytrocytenfenotype van de doos met zijn bloedgroep omvatten, en compatibiliteitstests moeten naar best vermogen worden uitgevoerd vóór de toepassing van dit geneesmiddel.
De hierboven beschreven DTT-deactiveringstechniek vormt in alle gevallen een alternatieve maatregel voor de transfusieveiligheid. Onze bloedbank is een pionier in ons land bij de toepassing van deze recent beschreven en internationaal gevalideerde techniek.13 In kritieke noodsituaties bij transfusies, waarbij het leven van de patiënt in gevaar is, mag echter alleen bloed worden getransfundeerd met ABO- en RhD-compatibiliteit, zonder de compatibiliteitstests uit te voeren volgens de eerder beschreven beleidslijnen en procedures bij noodtransfusies.
Conflict of interest
De auteurs hebben geen belangenconflicten aan te geven.