Wereldwijd hebben 36 miljoen mensen een volledig gezichtsverlies1. Zij kunnen geen vormen of zelfs geen lichtbronnen zien. Voor de meeste van deze mensen is hun blindheid het gevolg van herstelbare problemen zoals staar – ze hebben gewoon geen toegang tot de juiste gezondheidszorg. De overige miljoenen mensen zijn echter blind als gevolg van aandoeningen waarvoor momenteel geen effectieve behandeling bestaat.
“Blindheid is een van de meest levensveranderende aandoeningen die iemand kan meemaken,” zegt William Hauswirth, oogarts aan de Universiteit van Florida in Gainesville. Naast de problemen die het met zich meebrengt bij mobiliteit en het vinden van werk, wordt slechtziendheid in verband gebracht met een groot aantal andere gezondheidsproblemen, waaronder slapeloosheid, angst en depressie, en zelfs het risico op zelfmoord. “Herstel van het gezichtsvermogen zou een bijna onvoorstelbare verbetering van de levenskwaliteit betekenen”, aldus Hauswirth.
In landen met hoge inkomens waar routinematig aandacht wordt besteed aan de oorzaken van slechtziendheid die te voorkomen zijn, is degeneratie van het netvlies de belangrijkste oorzaak van blindheid. Dit weefsel bevindt zich aan de achterkant van het oog en bevat gespecialiseerde cellen die op licht reageren en visuele signalen verwerken, en is daarom van cruciaal belang voor het gezichtsvermogen. Fotoreceptorcellen – neuronen die bekend staan als staafjes en kegeltjes – zetten licht dat op het netvlies valt om in elektrochemische signalen. Deze signalen worden vervolgens gefilterd door een complex netwerk van andere neuronen, waaronder bipolaire cellen, amacriene cellen en horizontale cellen, voordat ze neuronen bereiken die bekend staan als retinale ganglioncellen. De lange projecties, of axonen, van deze cellen vormen de oogzenuw, waarlangs signalen van het netvlies worden vervoerd naar de visuele cortex van de hersenen, waar ze worden geïnterpreteerd als beelden.
Bij netvliesaandoeningen gaat het meestal om het verlies van fotoreceptorcellen, waardoor de gevoeligheid van het oog voor licht afneemt. Bij sommige netvliesaandoeningen, waaronder leeftijdsgebonden maculaire degeneratie (AMD), is dit verlies het gevolg van het falen van de epitheelcellen die een laag vormen aan de achterkant van het netvlies die bekend staat als het retinale pigmentepitheel (RPE). Het RPE houdt de fotoreceptorcellen gezond door giftige bijproducten, die ontstaan tijdens de reactie met licht, op te ruimen en door voedingsstoffen te leveren. Bij netvliesaandoeningen waarbij de fotoreceptoren in goede conditie blijven, is de belangrijkste oorzaak van blindheid de degeneratie van de retinale ganglioncellen.
Beluister een audio-versie van dit artikel
Uw browser ondersteunt het audio-element niet.
Diversiteit in de oorzaken van visuele beperkingen maakt het moeilijker om oplossingen te vinden. Maar vooruitgang op verschillende gebieden doet de hoop rijzen dat bijna alle vormen van netvliesaandoeningen behandelbaar zouden kunnen worden.
Eén benadering is het vergroten of omzeilen van beschadigde ogen met functionele prothesen. Dergelijke bionische ogen kunnen op dit moment slechts een beperkt gezichtsvermogen herstellen, maar onderzoekers blijven de mogelijkheden van de apparaten uitbreiden. Een andere optie is gentherapie. Deze therapie is al beschikbaar voor mensen met specifieke genetische mutaties, maar onderzoekers proberen deze aanpak uit te breiden naar meer mensen en aandoeningen. Sommige wetenschappers streven ook naar behandelingen op basis van een verwante techniek die bekend staat als optogenetica, waarbij cellen genetisch worden veranderd om de lichtgevoeligheid van het netvlies te herstellen. Dit werk bevindt zich nog in een vroeg stadium, maar onderzoekers hopen dat deze aanpak uiteindelijk een groot aantal mensen zal kunnen helpen, omdat de oorzaken van netvliesdegeneratie niet van belang zijn. En pogingen om verloren of beschadigde cellen van het netvlies te vervangen, hetzij in situ of door celtransplantaties, laten doorschemeren dat zelfs netvliesaandoeningen in een laat stadium uiteindelijk behandelbaar zouden kunnen worden.
Veel van dit onderzoek staat nog in de kinderschoenen. Maar Hauswirth is opgetogen over de vooruitgang die al is geboekt. Tien jaar geleden, zegt hij, moest hij patiënten vaak vertellen dat hij niets voor hen kon doen. “Voor veel van deze ziekten is dat totaal veranderd.”
Bionische ogen
Al bijna 30 jaar geleden begon Mark Humayun, biomedisch ingenieur aan de University of Southern California in Los Angeles, met het elektrisch stimuleren van het netvlies van mensen met blindheid. In samenwerking met collega’s van Second Sight Medical Products, een medisch technologiebedrijf in Sylmar, Californië, toonden zijn experimenten aan dat dergelijke stimulatie de visuele perceptie van lichtvlekken, fosfenen genaamd, kon induceren. Na een decennium van werk bij dieren om de hoeveelheid elektrische stroom vast te stellen die veilig op het oog kon worden toegepast, en gewapend met een enorm toegenomen kennis over het aantal en de soorten cellen die blijven bestaan in degenererende menselijke netvliezen, was Humayun’s team klaar om te beginnen werken met mensen. Tussen 2002 en 2004 implanteerden de onderzoekers een bionisch oog in elk van zes mensen die volledig of bijna volledig blind waren aan één oog – de eerste proef in zijn soort. De ontvangers van het apparaat, bekend als de Argus I, meldden dat ze fosfenen, richtingbewegingen en zelfs vormen konden waarnemen2. Ongeveer 300 mensen ervaren de wereld nu door de opvolger van dat apparaat, de Argus II, die in 2011 door de regelgevende instanties in Europa werd goedgekeurd voor gebruik bij mensen met retinitis pigmentosa – een groep zeldzame genetische aandoeningen die ervoor zorgen dat de fotoreceptorcellen degenereren. De Amerikaanse Food and Drug Administration (FDA) volgde twee jaar later.

Het Argus II implantaat bestaat uit een elektroden-array dat op het oppervlak van het netvlies wordt bevestigd.Credit: Ringo Chiu/ZUMA /Alamy
Om met een Argus II te worden uitgerust, ondergaan patiënten een operatie waarbij een chip met een elektrode-array op het netvlies wordt bevestigd. Om met het apparaat te kunnen “zien”, stuurt een miniatuurvideocamera op een bril signalen door naar een verwerkingseenheid die door de ontvanger wordt gedragen. De processor zet de signalen om in instructies die draadloos worden doorgegeven aan het geïmplanteerde apparaat. De elektroden stimuleren vervolgens de ganglioncellen aan de voorzijde van het netvlies. Het gebruik van de prothese is een leerproces. De ontvangers moeten hun hersenen trainen om het nieuwe type informatie dat ze ontvangen te interpreteren. En omdat de videocamera de beweging van het oog niet volgt, moeten ze ook leren hun hoofd te bewegen om hun blik te richten.
Het apparaat biedt slechts beperkt zicht. Gebruikers kunnen lichtbronnen en objecten met sterk contrasterende randen, zoals deuren of ramen, waarnemen en sommigen kunnen grote letters ontcijferen. Deze beperkingen zijn deels te wijten aan het feit dat de 60 elektroden van het apparaat een zeer lage resolutie hebben in vergelijking met de miljoenen fotoreceptorcellen in een gezond oog. Maar zelfs deze minimale verbetering kan het leven van mensen aanzienlijk verbeteren.
Waar de Argus II een epiretinaal implantaat is – wat betekent dat het op het oppervlak van het netvlies ligt – zijn andere apparaten die in ontwikkeling zijn ontworpen om onder het netvlies te worden geplaatst. Deze subretinale implantaten kunnen cellen stimuleren die zich dichter bij de cellen bevinden die normaal signalen naar het netvlies sturen – de fotoreceptorcellen. Door cellen hoger in het visuele pad te stimuleren, hopen onderzoekers meer van de signaalverwerking te behouden die door een gezond netvlies wordt uitgevoerd.
Retina Implant, een biotechnologiebedrijf dat is gevestigd in Reutlingen, Duitsland, heeft een subretinaal implantaat gebouwd dat fotodiodes (halfgeleiderelementen die licht omzetten in elektrische stroom) bevat die licht dat het oog binnenkomt rechtstreeks waarnemen. Hierdoor is er geen externe videocamera nodig en kan de gebruiker zijn blik op natuurlijke wijze richten. De stroom wordt geleverd door een handbediende eenheid, via een spoel die onder de huid boven het oor wordt geïmplanteerd. Alpha AMS, de huidige versie van het systeem, is in Europa goedgekeurd voor gebruik bij mensen met retinitis pigmentosa.
Pixium Vision in Parijs test een fotovoltaïsch subretinaal implantaat met de naam Prima. Het systeem projecteert signalen van een op een bril gemonteerde videocamera in het oog met behulp van bijna-infrarood licht, waarvan de golflengte de fotodiodes in het apparaat optimaal aanstuurt om netvliescellen te stimuleren. Door de beelden op deze manier te projecteren hebben de gebruikers enige controle over de richting van hun blik, omdat zij de scène kunnen verkennen door alleen hun ogen te bewegen. De stroom wordt ook geleverd door het bijna-infrarode licht, waardoor het implantaat draadloos is en de operatie om het aan te brengen minder gecompliceerd is. “Patiënten leren sneller te zien en de resolutie lijkt beter”, zegt José-Alain Sahel, oogarts aan de universiteit van Pittsburgh, Pennsylvania, die veiligheidstests met het apparaat uitvoert bij tien mensen met AMD. “Het is nog vroeg, maar dit is veelbelovend.”
Al deze apparaten werken alleen als er nog functionerende cellen in het netvlies aanwezig zijn. Bij veel voorkomende oogaandoeningen die voornamelijk fotoreceptorcellen aantasten, zoals retinitis pigmentosa en AMD, zijn er meestal nog wel wat cellen over om te stimuleren. Maar wanneer te veel netvliesganglioncellen afsterven, zoals gebeurt bij gevorderde diabetische retinopathie en glaucoom, kunnen dergelijke implantaten niet helpen. Voor mensen die door ziekte of letsel geen netvliesfunctie meer hebben, is een alternatieve bionische benadering wellicht zinvoller.
Humayun en zijn collega’s werken aan een systeem dat het oog omzeilt door signalen rechtstreeks naar de hersenen te sturen. Het idee is niet nieuw: in de jaren zeventig toonde de Amerikaanse biomedisch ingenieur William Dobelle aan dat directe stimulatie van de visuele cortex de waarneming van fosfenen teweegbracht3. Maar de bionische-oogtechnologie is nu pas bezig met een inhaalbeweging. Second Sight heeft Orion ontwikkeld, een systeem dat volgens Humayun “in wezen een aangepaste Argus II” is. Net als het origineel maakt het gebruik van een videocamera en een signaalprocessor die draadloos communiceren met een implantaat, maar de chip wordt op het oppervlak van de visuele cortex geplaatst in plaats van op het netvlies. Het apparaat wordt momenteel getest bij vijf mensen met beperkte of geen lichtwaarneming als gevolg van een oogletsel of schade aan het netvlies of de oogzenuw. “Tot nu toe zijn de resultaten goed,” zegt hij. “
Gezien het feit dat een deel van de technologie al bij mensen is beproefd en getest, is Humayun optimistisch dat het systeem binnen een paar jaar wettelijke goedkeuring zou kunnen krijgen. “Het is duidelijk dat hersenchirurgie een ander risiconiveau heeft, maar de procedure is vrij eenvoudig en de Orion zou veel meer patiënten kunnen helpen”, zegt hij. Er is echter veel minder bekend over het stimuleren van de hersenen om nuttig zicht te verschaffen. “We weten veel over het netvlies, maar heel weinig over de cortex,” zegt Botond Roska, een neurobioloog aan het Instituut voor Moleculaire en Klinische Oogheelkunde in Basel in Zwitserland. “Maar we zullen nooit genoeg weten als we het niet proberen,” zegt hij.
Gentherapie
Het oog is een ideaal doelwit voor gentherapie. Omdat het relatief op zichzelf staat, zouden de virussen die worden gebruikt om genen in de cellen van het netvlies te brengen, niet in staat moeten zijn om naar andere delen van het lichaam te reizen. En omdat het oog een immunoprivilegiegebied is, is het minder waarschijnlijk dat het immuunsysteem zich daar tegen zo’n virus zal verdedigen.
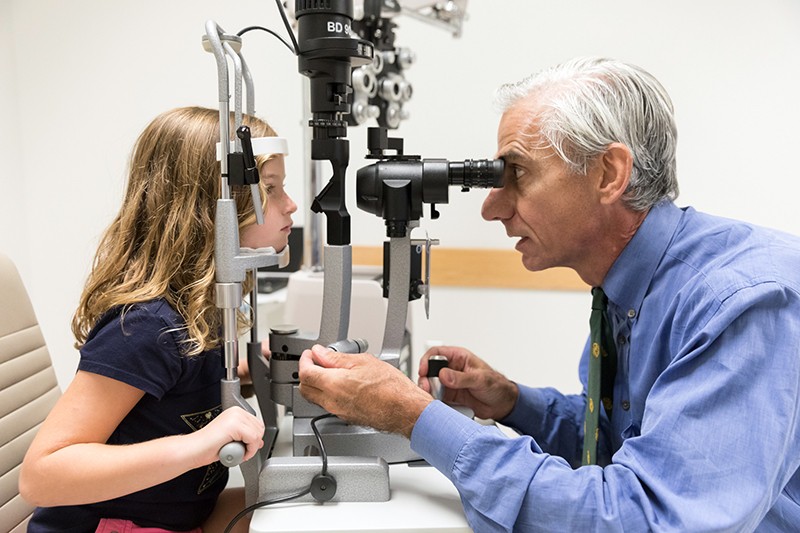
Oftalmoloog Albert Maguire bekijkt de ogen van een meisje met Leber congenitale amaurosis wiens gezichtsvermogen werd hersteld met de gentherapie voretigene neparvovec (Luxturna).Credit: Children’s Hospital of Philadelphia
In de eerste demonstratie van het potentieel van gentherapie om blindheid aan te pakken, hebben drie teams van onderzoekers de techniek gebruikt om met succes mensen met Leber congenitale amaurose (LCA) te behandelen. Deze erfelijke aandoening leidt tot ernstige visuele beperkingen en begint in de eerste jaren van het leven, en manifesteert zich vaak als nachtblindheid voordat het evolueert naar een breed gezichtsverlies dat begint aan de periferie van het gezichtsveld. Ongeveer 1 op de 40.000 baby’s heeft er last van.
De onderzoekers hebben zich gericht op een specifieke vorm van de aandoening die bekend staat als LCA 2. Deze wordt veroorzaakt door mutaties in RPE65, een gen dat door het RPE tot expressie wordt gebracht. Het gemuteerde gen beïnvloedt de RPE-functie negatief, wat op zijn beurt schade toebrengt aan de fotoreceptorcellen. In 2008 toonden de drie teams, waaronder een onder leiding van Hauswirth, in een vroeg stadium van klinische proeven aan dat het toedienen van een gezonde kopie van RPE65 aan het netvlies veilig was en leidde tot beperkte verbeteringen van het gezichtsvermogen4,5,6. Een fase III klinische studie onder leiding van Albert Maguire, een oogarts aan de Universiteit van Pennsylvania in Philadelphia, toonde in augustus 2017 aan dat mensen met LCA 2 die de behandeling kregen, beter in staat waren om hindernisbanen te navigeren op verschillende verlichtingsniveaus dan degenen die dat niet deden7. In december 2017 keurde de FDA de behandeling, voretigene neparvovec (Luxturna), goed, waarmee het de eerste gentherapie voor welke aandoening dan ook is die groen licht krijgt voor klinisch gebruik.
Het is mogelijk om LCA 2 op deze manier te behandelen omdat de betrokken genetische mutaties een recessief overervingspatroon vertonen. Dit betekent dat beide kopieën van RPE65 van een persoon de relevante mutaties moeten dragen om de aandoening te veroorzaken. Het leveren van een enkele, niet gemuteerde versie lost daarom het probleem op. Bij aandoeningen die worden veroorzaakt door dominant overervende mutaties is er echter maar één gemuteerde kopie van een gen nodig om de aandoening te manifesteren. In de meeste van deze gevallen zal het simpelweg toevoegen van een normale kopie van het gen niet helpen; in plaats daarvan moet het gemuteerde gen geïnactiveerd worden. Eén optie is het gen het zwijgen op te leggen door specifieke RNA-moleculen toe te voegen die de instructies van het gemuteerde gen voor het maken van het defecte eiwit onderscheppen, en vervolgens een normale kopie van het gen toe te dienen om zijn taken over te nemen – een aanpak die onderdrukking en vervanging wordt genoemd. Een andere methode is het corrigeren van de mutatie met de gen-editingtechniek CRISPR-Cas9. Onderzoekers van de Universiteit van Modena en Reggio Emilia in Modena, Italië, hebben deze aanpak in 2016 gedemonstreerd in een muismodel van retinitis pigmentosa8. Het jaar daarop gebruikte een team in de Verenigde Staten het om de mutatie te corrigeren die een type glaucoom veroorzaakt, zowel in muizen als in gekweekte menselijke cellen9.
Een belangrijke motor achter de vooruitgang van gentherapie is het gebruik van adeno-geassocieerd virus (AAV) om vervangende genen aan cellen af te leveren. AAV’s zijn veilig gebleken, gedeeltelijk omdat zij de neiging hebben niet in het genoom van hun gastheercel te integreren, waardoor het risico dat cellen kanker krijgen tot een minimum wordt beperkt. En door hun geringe omvang kunnen ze zich wijd verspreiden in het oog en daardoor een groot aantal cellen infecteren. Maar het vermogen van AAV’s om genen te leveren heeft zijn beperkingen: sommige genen zijn gewoon te groot voor AAV’s om te dragen, waaronder ABCA4, waarvan mutaties kunnen leiden tot de ziekte van Stargardt, een erfelijke vorm van maculaire degeneratie. Er worden twee omwegen gezocht. Bij de eerste wordt gebruik gemaakt van een virus met een groter draagvermogen, zoals een lentivirus, om vervangende genen af te leveren. De veiligheid en doeltreffendheid van deze aanpak zijn onbekend, maar klinische proeven zijn aan de gang. Een tweede strategie is om het vervangingsgen in tweeën te breken en elke helft afzonderlijk in de cel te brengen, samen met een middel om ze te recombineren. “Dat werkt op dit moment in ten minste één diermodel,” zegt Hauswirth.
Gentherapie heeft, ongeacht de benadering, een aanzienlijke beperking. Meer dan 250 genen zijn betrokken bij blindheid, en omdat elk gen kan worden aangetast door talrijke soorten mutaties, is het aantal potentiële therapeutische doelen enorm. Bijvoorbeeld, meer dan 100 mutaties in het gen RHO leiden tot retinitis pigmentosa, de meest voorkomende dominant overervende netvliesaandoening. Het ontwikkelen van een gentherapie voor elke mutatie is niet praktisch, zegt Hauswirth.
Onderzoekers werken aan een mogelijke oplossing die een draai geeft aan de onderdrukkings- en vervangingsaanpak. In plaats van zich te richten op exemplaren van RHO die een specifieke mutatie bevatten, gebruiken zij een RNA dat de expressie van het gen onderdrukt, ongeacht of RHO gemuteerd is of niet, terwijl zij een vervangend exemplaar afleveren dat immuun is voor het RNA dat de expressie onderdrukt. Een team onder leiding van Jane Farrar, een geneticus aan het Trinity College in Dublin, toonde in 2011 de belofte van deze strategie aan in een muismodel van dominante retinitis pigmentosa10. In 2018 testten Hauswirth en collega’s de aanpak bij honden met retinitis pigmentosa11. Zij toonden aan dat de degeneratie van fotoreceptorcellen in behandelde delen van het netvlies kon worden gestopt – een verbetering die ten minste acht maanden aanhield. Deze strategie pakt alle mutaties die dominant overervende retinitis pigmentosa kunnen veroorzaken in één enkele behandeling aan, en breidt daarom gentherapie “op een vrij eenvoudige manier” uit van recessief naar dominant overervende aandoeningen, aldus Hauswirth. Hij is van plan te bestuderen hoe goed honden die de behandeling hebben gekregen door een doolhof kunnen navigeren, en is de veiligheidsgegevens aan het verzamelen die nodig zijn om een klinische studie te starten.
Optogenetica
Gentherapie werkt alleen bij mensen bij wie de blindheid door een genetische mutatie wordt veroorzaakt. Het is ook niet geschikt om netvliesaandoeningen in het eindstadium aan te pakken, wanneer er onvoldoende cellen overblijven om te worden hersteld. Maar een verwante benadering op basis van een techniek die optogenetica wordt genoemd, is niet gebonden aan stoornissen en zou kunnen leiden tot behandelingen voor verschillende stadia van degeneratie. Bij optogenetica worden genen die cellen in staat stellen lichtgevoelige eiwitten, opsines genaamd, te produceren, toegediend door een virus. Het introduceren van opsines kan de lichtgevoeligheid van beschadigde fotoreceptoren enigszins herstellen, of zelfs andere cellen van het netvlies, waaronder bipolaire cellen of retinale ganglioncellen, gevoelig maken voor licht.

Optogenetica is gebruikt om de lichtgevoeligheid van kegelcellen (groen) te herstellen in een muismodel van retinitis pigmentosa; het succes van de techniek is geëvalueerd door de activiteit te meten van een retinale ganglioncel (magenta), die door kegels wordt gestimuleerd als reactie op licht.Credit: IOB.ch
Problematisch is echter dat, terwijl fotoreceptorcellen in het oog een breed spectrum aan lichtintensiteiten aankunnen – en dus zowel in fel zonlicht als in de schemering goed werken – opsines een beperkt bereik hebben en vaak beter presteren bij hoge lichtintensiteiten. Een mogelijke oplossing is een opzet die vergelijkbaar is met het Prima bionische-oogsysteem van Pixium Vision, waarbij ontvangers een bril krijgen met een videocamera die het zicht van de gebruiker vastlegt en een projector die in hun oog wijst. Net als bij Prima is het voordeel dat de aard van het licht dat het oog binnenvalt, kan worden afgestemd op de modificatie van het netvlies; in dit geval worden echter de intensiteit en de golflengte gekozen die de nieuw ingebrachte opsines het best aansturen, in plaats van geïmplanteerde fotodiodes.
GenSight Biologics, een biotechnologiebedrijf in Parijs dat Sahel en Roska tot zijn oprichters rekent, is al bezig met het testen van zo’n systeem. Het is de bedoeling een opsine toe te dienen aan netvliesganglioncellen, maar er is een potentieel probleem: netvliesganglioncellen zijn van nature gevoelig voor licht. Zij brengen melanopsine tot expressie, een eiwit dat betrokken is bij de pupilreflex, waarbij de pupil van het oog zich vernauwt als reactie op fel licht. Om te voorkomen dat dit gebeurt, gebruiken de onderzoekers van GenSight een opsine dat reageert op rode golflengten van licht, omdat melanopsine bij voorkeur reageert op licht aan de blauwe kant van het spectrum. Het bedrijf begon in oktober 2018 met een klinische proef in een vroeg stadium bij mensen met gevorderde retinitis pigmentosa die nog maar minimaal zicht hebben. De proef zal cohorten uit het Verenigd Koninkrijk, Frankrijk en de Verenigde Staten omvatten, en de eerste resultaten worden eind 2020 verwacht.
“Dit is een eenvoudige benadering, en we zullen moeten zien wat er wordt gewonnen,” zegt Roska. “Daarna kunnen we overgaan op meer en geavanceerdere benaderingen.” Een probleem dat blijft bestaan, is dat bij veel van de aandoeningen die met optogenetische technieken zouden kunnen worden behandeld, sprake is van degeneratie van specifieke delen van het netvlies, waarbij in andere gebieden nog bruikbaar zicht overblijft. Het licht dat opsines aanstuurt is zichtbaar en zou het resterende natuurlijke zicht kunnen verstoren. In de toekomst zouden opsines die reageren op bijna-infrarood licht optogenetica-behandelingen in staat kunnen stellen samen te werken met het resterende natuurlijke gezichtsvermogen.
Celregeneratie
Stamceltherapie zou mogelijk blindheid kunnen genezen, zelfs in de late stadia van de ziekte. Omdat stamcellen kunnen worden omgevormd tot elk type cel, kunnen ze worden gebruikt om nieuwe netvliescellen te kweken voor transplantatie in het oog ter vervanging van de cellen die verloren zijn gegaan. Studies bij dieren hebben echter aangetoond dat slechts een klein deel van de getransplanteerde neuronen in staat is correct te integreren in het complexe neurale circuit van het netvlies. Dit is een aanzienlijk obstakel voor stamcelbehandelingen die gericht zijn op het vervangen van netvliesneuronen.

De complexe cellulaire structuur van het netvlies omvat lagen fotoreceptoren (groen) en bloedvaten en zenuwen (magenta).Credit: Louise Hughes/SPL
De cellen waaruit het retinale pigmentepitheel is opgebouwd, bevinden zich buiten het circuit van het netvlies. Op stamcellen gebaseerde therapieën zijn daarom veelbelovend voor aandoeningen zoals AMD en retinitis pigmentosa, waarbij de RPE-cellen degenereren. “Fotoreceptoren moeten verbinding maken met het circuit, maar het retinale pigment epitheel niet,” zegt Roska. “Dat is waar mensen het dichtst bij zijn om vooruitgang te boeken.” Aanvankelijk probeerden onderzoekers het netvlies te injecteren met uit stamcellen afgeleide RPE-cellen in suspensie, maar er bleven er te weinig hangen waar ze nodig waren. Verschillende teams denken nu dat een betere aanpak is om RPE-cellen in het oog te transplanteren als een voorgevormde plaat die vervolgens op zijn plaats wordt gehouden door een biocompatibele steiger. “De steigerbenadering is een enorme verbetering, vergeleken met suspensie, voor RPE-cellen,” zegt Sahel.
In maart 2018 kondigde het London Project to Cure Blindness – een samenwerking tussen University College London en Moorfields Eye Hospital in Londen – de bevindingen aan van een fase I-studie waarbij een vel RPE-cellen werd geïmplanteerd in de retina’s van twee mensen met natte AMD (een zeldzame, ernstige vorm van AMD waarbij sprake is van abnormale groei en lekkage van bloedvaten). Beide patiënten verdroegen de procedure goed en waren in staat 21-29 meer letters op een leeskaart te lezen dan vóór de behandeling12. De volgende maand meldde een team onder leiding van Humayun soortgelijke fase I-resultaten bij vijf mensen met droge AMD, de meer voorkomende vorm van de aandoening13. Deze eerste resultaten zijn veelbelovend. “Dit heeft tot veel opwinding geleid,” zegt Humayun. Maar de bevindingen moeten worden bevestigd door fase III-onderzoek bij een groter aantal deelnemers, en Humayun waarschuwt dat de behandeling nog vele jaren verwijderd kan zijn van gebruik in de kliniek, omdat nog geen stamceltherapie voor een netvliesaandoening het goedkeuringsproces heeft doorlopen.
Een verwante benadering, die zich nog in de vroege stadia van fundamenteel onderzoek bevindt, zou de hoop kunnen waarmaken dat verloren neuronen worden vervangen, waardoor de deur wordt geopend naar behandelingen voor een grote verscheidenheid aan oogziekten. Bij de mens delen rijpe neuronen zich niet en kunnen zij zich dus niet regenereren, wat het herstel van het gezichtsvermogen bijzonder moeilijk maakt. Maar dat geldt niet voor alle dieren. Reptielen en bepaalde vissen kunnen netvliesneuronen regenereren, en ook vogels hebben een zekere regeneratieve capaciteit. Thomas Reh, een neurowetenschapper aan de Universiteit van Washington in Seattle, probeert dit vermogen bij mensen te ontsluiten. Maar in plaats van in het laboratorium gekweekte cellen te transplanteren, probeert Reh cellen die zich al in het netvlies bevinden te laten differentiëren tot nieuwe neuronen.
In 2001 suggereerde Reh dat Müller glia – cellen die structuur geven aan het netvlies en de functie ervan ondersteunen – de bron zijn van nieuwe neuronen die bij vissen en vogels zijn waargenomen14. Hij en zijn team zijn toen gaan uitzoeken of Müller glia kunnen worden gebruikt om nieuwe neuronen te genereren bij muizen. In 2015 ontwikkelden ze muizen om Ascl1 te maken, een eiwit dat belangrijk is voor de productie van neuronen bij vissen, en beschadigden vervolgens de netvliezen van de dieren15. Hun hoop was dat Ascl1 Müller glia zou uitlokken om te transformeren in neuronen.
Het experiment slaagde er niet in om nieuwe neuronen te produceren in volwassen muizen, maar wel in jonge muizen. Nikolas Jorstad, biochemicus en promovendus in het team van Rehs, stelde voor dat chemische modificaties die tijdens de ontwikkeling worden aangebracht in chromatine (een complex van DNA, RNA en eiwitten) in de celkern, in volwassen cellen de toegang zouden kunnen blokkeren tot genen die Müller glia in staat stellen om te transformeren in neuronen. In augustus 2017 toonde Reh’s team aan dat door de introductie van een enzym dat dergelijke modificaties omkeert, ze Müller glia konden overhalen om te differentiëren16. “Voor het eerst konden we neuronen regenereren in de volwassen muis”, zegt Reh. “Na al die jaren was ik behoorlijk opgewonden.” Hoewel het geen echte fotoreceptorcellen waren, en meer leken op bipolaire cellen, sloten de neuronen aan op het bestaande circuit, en waren ze gevoelig voor licht. “Ik was verbaasd dat ze zo goed verbinding maakten,” zegt Reh.
Hoewel ze nog lang niet klaar zijn om netvliesaandoeningen bij mensen te behandelen, heeft het werk een enorm potentieel. De volgende stap is het herhalen van de studies bij dieren met ogen die meer lijken op die van de mens. Het team van Reh werkt al met netvliescelculturen van niet-menselijke primaten. De onderzoekers moeten ook uitzoeken hoe ze het differentiatieproces kunnen sturen om specifieke celtypes zoals staafjes en kegeltjes te produceren. “
Nu we een voet tussen de deur hebben bij het maken van neuronen, zouden kegeltjes geweldig zijn,” zegt Reh.
Als de aanpak slaagt, zou hij op grote schaal kunnen worden toegepast. “Uiteindelijk zal dit de manier zijn waarop al deze oogziekten zullen worden behandeld,” voorspelt Reh. “Het is gewoon logisch. Je hoeft je geen zorgen te maken over de juiste transplantatie. Je cellen zijn precies waar je ze nodig hebt.”
Humayun is ook bemoedigd door het werk. “Ik juich iedereen met een nieuw goed idee toe,” zegt hij. “Het is erg vroeg, het is een hoog risico, maar zeg nooit nooit. Dat is wat ik heb geleerd.”