Na całym świecie 36 milionów ludzi cierpi na całkowitą utratę wzroku1. Nie widzą oni kształtów, a nawet źródeł światła. W przypadku większości z tych osób ślepota wynika z problemów, które można naprawić, takich jak zaćma – po prostu brakuje im dostępu do odpowiedniej opieki zdrowotnej. Pozostałe miliony są jednak niewidome z powodu schorzeń, na które obecnie nie ma skutecznego leczenia.
„Ślepota jest jednym z najbardziej zmieniających życie stanów, jakich człowiek może doświadczyć” – mówi William Hauswirth, okulista z Uniwersytetu Florydy w Gainesville. Oprócz trudności w poruszaniu się i znalezieniu pracy, upośledzenie wzroku wiąże się z szeregiem innych problemów zdrowotnych, w tym bezsennością, lękami i depresją, a nawet ryzykiem samobójstwa. „Przywrócenie użytecznego widzenia pozwoliłoby na niewyobrażalną poprawę jakości życia” – mówi Hauswirth.
W krajach o wysokich dochodach, w których rutynowo zajmuje się możliwymi do uniknięcia przyczynami upośledzenia wzroku, główną przyczyną ślepoty jest zwyrodnienie siatkówki. Znajdująca się w tylnej części oka tkanka zawiera wyspecjalizowane komórki, które reagują na światło i przetwarzają sygnały wizualne, a zatem ma kluczowe znaczenie dla widzenia. Komórki fotoreceptorowe – neurony znane powszechnie jako pręciki i czopki – przekształcają światło, które uderza w siatkówkę, w sygnały elektrochemiczne. Sygnały te następnie przechodzą przez złożoną sieć innych neuronów, w tym komórki dwubiegunowe, amakrynowe i horyzontalne, zanim dotrą do neuronów zwanych komórkami zwojowymi siatkówki. Długie wypustki lub aksony tych komórek tworzą nerw wzrokowy, wzdłuż którego sygnały z siatkówki są przenoszone do kory wzrokowej mózgu, gdzie są interpretowane jako obrazy.
Zaburzenia siatkówki powszechnie wiążą się z utratą komórek fotoreceptorowych, co powoduje zmniejszenie wrażliwości oka na światło. W niektórych zaburzeniach siatkówki, w tym w zwyrodnieniu plamki związanym z wiekiem (AMD), utrata ta wynika z awarii komórek nabłonka, które tworzą warstwę w tylnej części siatkówki, znaną jako nabłonek barwnikowy siatkówki (RPE). RPE utrzymuje komórki fotoreceptorów w zdrowiu poprzez oczyszczanie ich z toksycznych produktów ubocznych powstających podczas reakcji ze światłem, a także poprzez dostarczanie składników odżywczych. W zaburzeniach siatkówki, w których fotoreceptory pozostają w dobrej kondycji, główną przyczyną ślepoty jest degeneracja komórek zwojowych siatkówki.
Posłuchaj wersji audio tego artykułu
Twoja przeglądarka nie obsługuje elementu audio.
Różnorodność przyczyn upośledzenia wzroku utrudnia znalezienie rozwiązań. Jednak postępy w kilku dziedzinach budzą nadzieję, że prawie wszystkie formy zaburzeń siatkówki mogą stać się uleczalne.
Jednym z podejść jest rozszerzenie lub ominięcie uszkodzonych oczu za pomocą funkcjonalnych protez. Takie bioniczne oczy mogą przywrócić tylko ograniczoną wizję w chwili obecnej, ale badacze kontynuują nacisk na możliwości urządzeń. Inną opcją jest terapia genowa. Jest ona już dostępna dla osób z określonymi mutacjami genetycznymi, a naukowcy starają się rozszerzyć to podejście na większą liczbę osób i schorzeń. Niektórzy naukowcy poszukują również metod leczenia opartych na pokrewnej technice zwanej optogenetyką, która polega na genetycznej zmianie komórek w celu przywrócenia wrażliwości siatkówki na światło. Prace w tym zakresie są na wczesnym etapie, ale naukowcy mają nadzieję, że dzięki temu podejściu będą mogli ostatecznie pomóc wielu osobom, ponieważ jest ono niezależne od przyczyn zwyrodnienia siatkówki. A wysiłki zmierzające do zastąpienia utraconych lub uszkodzonych komórek siatkówki, zarówno in situ, jak i poprzez przeszczepy komórek, wskazują, że nawet późne zaburzenia siatkówki mogą w końcu stać się uleczalne.
Większość tych badań jest w powijakach. Ale Hauswirth jest optymistą, jeśli chodzi o postępy, które już zostały poczynione. Jak mówi, dziesięć lat temu często musiał mówić pacjentom, że nic nie może dla nich zrobić. „W przypadku wielu z tych chorób, to się całkowicie zmieniło.”
Bioniczne oczy
Prawie 30 lat temu, Mark Humayun, inżynier biomedyczny z Uniwersytetu Południowej Kalifornii w Los Angeles, zaczął elektrycznie stymulować siatkówki ludzi niewidomych. Współpracując z kolegami z Second Sight Medical Products, firmy zajmującej się technologiami medycznymi w Sylmar w Kalifornii, jego eksperymenty wykazały, że taka stymulacja może wywołać wizualną percepcję plam światła zwanych fosfenami. Po dekadzie pracy na zwierzętach w celu ustalenia ilości prądu elektrycznego, który można bezpiecznie przyłożyć do oka, i uzbrojony w znacznie większą wiedzę na temat liczby i typów komórek, które utrzymują się w degenerującej się ludzkiej siatkówce, zespół Humayuna był gotowy do rozpoczęcia pracy z ludźmi. W latach 2002-2004 badacze wszczepili bioniczne oko każdej z sześciu osób, u których stwierdzono całkowitą lub prawie całkowitą ślepotę w jednym oku – była to pierwsza tego typu próba. Osoby, które otrzymały to urządzenie, znane jako Argus I, zgłaszały, że są w stanie postrzegać fenomeny, ruchy kierunkowe, a nawet kształty2. Obecnie około 300 osób poznaje świat za pomocą następcy tego urządzenia, Argusa II, który został zatwierdzony przez regulatorów w Europie w 2011 roku do stosowania u osób z pigmentozą siatkówki – grupą rzadkich zaburzeń genetycznych, które powodują degenerację komórek fotoreceptorowych. Amerykańska Agencja ds. Żywności i Leków (FDA) podążyła za tym przykładem dwa lata później.

Implant Argus II składa się z układu elektrod, który jest przymocowany do powierzchni siatkówki.Credit: Ringo Chiu/ZUMA /Alamy
Aby zostać wyposażonym w implant Argus II, pacjenci przechodzą operację, podczas której chip zawierający układ elektrod zostaje przymocowany do powierzchni siatkówki. Aby „widzieć” za pomocą urządzenia, miniaturowa kamera wideo zamontowana na parze okularów przekazuje sygnały do procesora, który jest noszony przez odbiorcę. Procesor przekształca sygnały w instrukcje, które są przesyłane bezprzewodowo do wszczepionego urządzenia. Następnie elektrody stymulują komórki zwojowe siatkówki w jej przedniej części. Używanie protezy jest procesem uczenia się. Odbiorcy muszą trenować swój mózg, aby interpretować nowy rodzaj odbieranych informacji. A ponieważ kamera wideo nie śledzi ruchu oka, muszą również nauczyć się poruszać głową, aby kierować spojrzeniem.
Urządzenie zapewnia jedynie ograniczone widzenie. Użytkownicy mogą wykrywać źródła światła i obiekty o wysokim kontraście krawędzi, takie jak drzwi lub okna, a niektórzy mogą odszyfrować duże litery. Ograniczenia te wynikają częściowo z tego, że 60 elektrod urządzenia zapewnia bardzo niską rozdzielczość w porównaniu z milionami komórek fotoreceptorowych w zdrowym oku. Jednak nawet to minimalne usprawnienie może znacznie poprawić życie ludzi.
Podczas gdy Argus II jest implantem epiretinalnym – co oznacza, że leży na powierzchni siatkówki – inne opracowywane urządzenia są przeznaczone do umieszczania pod siatkówką. Implanty podsiatkówkowe mogą stymulować komórki, które znajdują się bliżej tych, które normalnie wysyłają sygnały do siatkówki – komórki fotoreceptorowe. Stymulując komórki znajdujące się wyżej na drodze wzrokowej, badacze mają nadzieję zachować więcej z przetwarzania sygnałów, które są wykonywane przez zdrową siatkówkę.
Retina Implant, firma biotechnologiczna z siedzibą w Reutlingen w Niemczech, zbudowała implant podsiatkówkowy składający się z fotodiod (urządzeń półprzewodnikowych, które przekształcają światło w prąd elektryczny), które bezpośrednio wyczuwają światło wpadające do oka. Eliminuje to potrzebę stosowania zewnętrznej kamery wideo, umożliwiając użytkownikom naturalne kierowanie wzroku. Zasilanie jest dostarczane przez ręczne urządzenie, poprzez cewkę, która jest wszczepiana pod skórę nad uchem. Alpha AMS, obecna wersja systemu, uzyskała aprobatę prawną w Europie do stosowania u osób z retinitis pigmentosa.
Pixium Vision w Paryżu testuje fotowoltaiczny implant podsiatkówkowy o nazwie Prima. System rzutuje sygnały z kamery wideo zamontowanej na okularach do oka za pomocą światła bliskiej podczerwieni, którego długość fali optymalnie napędza fotodiody w urządzeniu do stymulacji komórek siatkówki. Projekcja obrazów w ten sposób daje użytkownikom pewną kontrolę nad kierunkiem ich spojrzenia, ponieważ mogą oni badać scenę poruszając jedynie oczami. Zasilanie jest również zapewniane przez światło bliskiej podczerwieni, dzięki czemu implant jest bezprzewodowy, a operacja jego zamontowania mniej skomplikowana. „Pacjenci uczą się, jak szybciej odzyskać wzrok, a rozdzielczość wydaje się lepsza” – mówi José-Alain Sahel, okulista z Uniwersytetu w Pittsburghu w Pensylwanii, który prowadzi badania bezpieczeństwa urządzenia na dziesięciu osobach z AMD. „To dopiero początek, ale jest to bardzo obiecujące.”
Wszystkie te urządzenia działają tylko wtedy, gdy w siatkówce pozostają sprawne komórki. W powszechnych chorobach oczu, które wpływają głównie na komórki fotoreceptorowe, w tym retinitis pigmentosa i AMD, zwykle pozostaje kilka komórek do stymulacji. Jednak gdy zbyt wiele komórek zwojowych siatkówki obumiera, jak to ma miejsce w zaawansowanej retinopatii cukrzycowej i jaskrze, takie implanty nie są w stanie pomóc. W przypadku osób, którym nie pozostały żadne funkcje siatkówki, czy to z powodu choroby, czy urazu, alternatywne bioniczne podejście może być bardziej odpowiednie.
Humayun i jego koledzy pracują nad systemem, który omija oko, wysyłając sygnały prosto do mózgu. Pomysł nie jest nowy: w latach 70. amerykański inżynier biomedyczny William Dobelle wykazał, że bezpośrednia stymulacja kory wzrokowej wywołuje postrzeganie zjawisk fenomenalnych3. Jednak technologia bionicznych oczu dopiero teraz nadrabia zaległości. Firma Second Sight opracowała Oriona, system, który według Humayuna jest „w zasadzie zmodyfikowanym Argusem II”. Podobnie jak oryginał, wykorzystuje on kamerę wideo i procesor sygnałowy, które komunikują się bezprzewodowo z implantem, ale chip jest umieszczony na powierzchni kory wzrokowej, a nie na siatkówce. Urządzenie jest obecnie testowane na pięciu osobach z ograniczoną percepcją światła lub jej brakiem z powodu urazu oka, uszkodzenia siatkówki lub nerwu wzrokowego. „Jak na razie wyniki są dobre,” mówi. „Nie jesteśmy jeszcze niczym zaskoczeni.”
Zważywszy, że niektóre z technologii są już wypróbowane i przetestowane u ludzi, Humayun jest optymistą, że system może uzyskać zatwierdzenie regulacyjne w ciągu kilku lat. „Oczywiście, operacje mózgu wiążą się z innym poziomem ryzyka, ale procedura jest dość prosta, a Orion może pomóc znacznie większej liczbie pacjentów” – mówi. Jednak znacznie mniej wiadomo na temat stymulacji mózgu w celu zapewnienia użytecznego widzenia. „Wiemy dużo o siatkówce, ale bardzo mało o korze mózgowej” – mówi Botond Roska, neurobiolog z Instytutu Okulistyki Molekularnej i Klinicznej w Bazylei w Szwajcarii. „Ale nigdy nie dowiemy się wystarczająco dużo, jeśli nie będziemy próbować”, mówi.
Terapia genowa
Oko jest idealnym celem dla terapii genowej. Ponieważ jest stosunkowo niezależne, wirusy, które są używane do przenoszenia genów do komórek siatkówki, nie powinny być w stanie podróżować do innych części ciała. A ponieważ oko jest miejscem uprzywilejowanym pod względem immunologicznym, jest mniej prawdopodobne, że układ odpornościowy podejmie tam obronę przed takim wirusem.
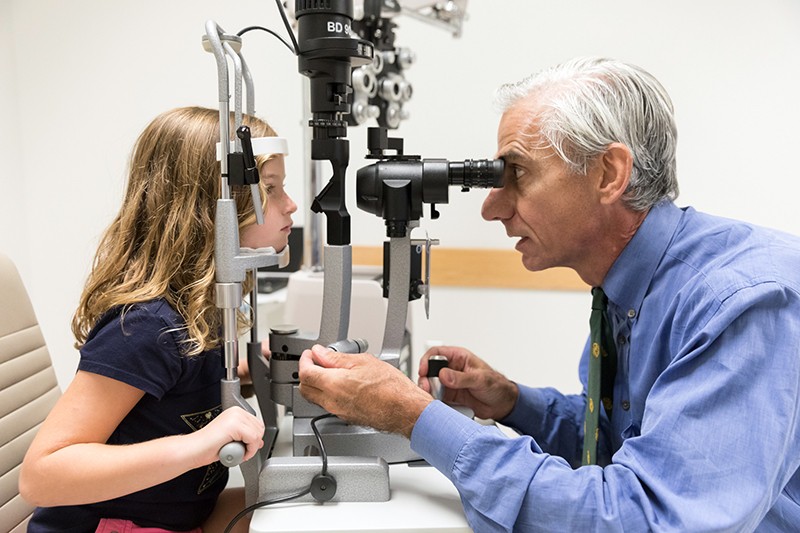
Ophthalmologist Albert Maguire examines the eyes of a girl with Leber congenital amaurosis whose sight was restored by the gene therapy voretigene neparvovec (Luxturna).Credit: Children’s Hospital of Philadelphia
W pierwszej demonstracji potencjału terapii genowej w walce ze ślepotą, trzy zespoły badaczy wykorzystały tę technikę do skutecznego leczenia osób z wrodzoną amaurozą Lebera (LCA). Ta dziedziczna choroba prowadzi do poważnego upośledzenia wzroku i rozpoczyna się w pierwszych kilku latach życia, często objawiając się ślepotą nocną, a następnie postępującą utratą wzroku, która zaczyna się na obrzeżach pola widzenia. Choroba dotyka około 1 na 40 000 dzieci.
Badacze postanowili zająć się specyficzną formą tej choroby, znaną jako LCA 2. Jest ona spowodowana mutacjami w RPE65, genie, który jest wyrażany przez RPE. Zmutowany gen negatywnie wpływa na funkcjonowanie RPE, co z kolei powoduje uszkodzenie komórek fotoreceptorowych. W 2008 roku trzy zespoły, w tym jeden kierowany przez Hauswirtha, wykazały w badaniach klinicznych na wczesnym etapie, że dostarczenie zdrowej kopii RPE65 do siatkówki jest bezpieczne i prowadzi do ograniczonej poprawy widzenia4,5,6. Badanie kliniczne III fazy prowadzone przez Alberta Maguire’a, okulistę z University of Pennsylvania w Filadelfii, wykazało w sierpniu 2017 r., że osoby z LCA 2, które otrzymały leczenie, były w stanie lepiej poruszać się po torach przeszkód przy różnych poziomach oświetlenia niż osoby, które tego nie robiły7. W grudniu 2017 r. FDA zatwierdziła leczenie, voretigene neparvovec (Luxturna), czyniąc z niego pierwszą terapię genową dla jakiegokolwiek schorzenia, która otrzymała zielone światło do użytku klinicznego.
Możliwe jest leczenie LCA 2 w ten sposób, ponieważ zaangażowane mutacje genetyczne wykazują recesywny wzór dziedziczenia. Oznacza to, że obie kopie RPE65 danej osoby muszą nosić odpowiednie mutacje, aby wywołać zaburzenie. Dostarczenie pojedynczej, niezmutowanej wersji rozwiązuje problem. Choroby, które są powodowane przez mutacje dziedziczone dominująco, wymagają jednak tylko jednej zmutowanej kopii genu, aby się ujawnić. W większości z nich, zwykłe dodanie normalnej kopii genu nie pomoże; zamiast tego, zmutowany gen musi zostać unieszkodliwiony. Jedną z opcji jest wyciszenie go poprzez dodanie specyficznych cząsteczek RNA, które przechwytują instrukcje zmutowanego genu dotyczące wytwarzania wadliwego białka, a następnie dostarczenie normalnej kopii genu, która przejmie jego obowiązki – podejście określane jako tłumienie i zastępowanie. Innym sposobem jest korekta mutacji za pomocą techniki edycji genów CRISPR-Cas9. Naukowcy z Uniwersytetu Modeny i Reggio Emilia w Modenie we Włoszech zademonstrowali to podejście w mysim modelu pigmentozy siatkówki8 w 2016 roku. W następnym roku zespół w Stanach Zjednoczonych wykorzystał ją do skorygowania mutacji powodującej pewien rodzaj jaskry zarówno u myszy, jak i w hodowanych komórkach ludzkich9.
Ważnym motorem postępu terapii genowej było wykorzystanie wirusa adeno-asocjowanego (AAV) do dostarczania genów zastępczych do komórek. Wykazano, że AAV są bezpieczne, częściowo dlatego, że nie mają tendencji do integrowania się z genomem komórki gospodarza, co minimalizuje ryzyko przekształcenia się komórek w nowotworowe. A ich niewielki rozmiar umożliwia im szerokie rozprzestrzenianie się w oku, a tym samym infekowanie dużej liczby komórek. Jednak zdolność AAV do przenoszenia genów ma swoje granice: niektóre geny są po prostu zbyt duże, aby AAV mogły je przenosić, w tym ABCA4, którego mutacje mogą prowadzić do choroby Stargardta, dziedzicznej formy zwyrodnienia plamki żółtej. Obecnie poszukiwane są dwa obejścia tego problemu. Pierwszy z nich wykorzystuje wirus o większej zdolności przenoszenia, taki jak lentiwirus, do dostarczania genów zastępczych. Bezpieczeństwo i skuteczność tego podejścia nie są znane, ale próby kliniczne są w toku. Druga strategia polega na podzieleniu genu zastępczego na dwie części i przetransportowaniu każdej połówki osobno do komórki, wraz ze sposobem ich rekombinacji. „To działa już teraz w co najmniej jednym modelu zwierzęcym” – mówi Hauswirth.
Niezależnie od podejścia, terapia genowa ma poważne ograniczenia. W ślepotę zaangażowanych jest ponad 250 genów, a ponieważ każdy z nich może być dotknięty wieloma rodzajami mutacji, liczba potencjalnych celów terapeutycznych jest ogromna. Na przykład, ponad 100 mutacji w genie RHO prowadzi do retinitis pigmentosa, najczęstszego dziedziczonego dominująco schorzenia siatkówki. Opracowanie terapii genowej dla każdej mutacji jest niepraktyczne, mówi Hauswirth.
Badacze pracują nad potencjalnym rozwiązaniem, które polega na zastosowaniu podejścia „tłumienie i zastępowanie”. Zamiast celować w kopie RHO zawierające specyficzną mutację, używają wyciszającego RNA, aby stłumić całą ekspresję genu, niezależnie od tego, czy RHO jest zmutowany czy nie, podczas gdy dostarczają kopię zastępczą, która jest odporna na wyciszające RNA. Zespół kierowany przez Jane Farrar, genetyka z Trinity College w Dublinie, pokazał obietnicę tej strategii w 2011 roku w mysim modelu dominującego pigmentosa retinitis10. W 2018 r. Hauswirth i współpracownicy przetestowali to podejście u psów z retinitis pigmentosa11. Wykazali, że degeneracja komórek fotoreceptorowych w leczonych obszarach siatkówki może zostać zatrzymana – poprawa, która utrzymywała się przez co najmniej osiem miesięcy. Strategia ta zwalcza wszystkie mutacje, które mogą powodować dziedziczone dominująco barwnikowe zapalenie siatkówki w pojedynczym zabiegu, a zatem rozszerza terapię genową z chorób dziedziczonych recesywnie na dziedziczone dominująco „w dość prosty sposób”, mówi Hauswirth. Planuje on zbadać, jak dobrze psy, które otrzymały leczenie, mogą poruszać się w labiryncie i zbiera dane dotyczące bezpieczeństwa wymagane do rozpoczęcia badań klinicznych.
Optogenetyka
Terapia genowa działa tylko u osób, u których ślepota jest spowodowana mutacją genetyczną. Nie jest też odpowiednia do walki z chorobami siatkówki w stadium końcowym, w którym pozostaje niewystarczająca liczba komórek do naprawy. Jednak pokrewne podejście oparte na technice zwanej optogenetyką jest niezależne od zaburzeń i może prowadzić do leczenia różnych stadiów degeneracji. W optogenetyce geny, które umożliwiają komórkom produkcję wrażliwych na światło białek zwanych opsynami, są dostarczane przez wirusy. Wprowadzenie opsyn może przywrócić wrażliwość na światło uszkodzonym fotoreceptorom, a nawet sprawić, że inne komórki siatkówki, w tym komórki dwubiegunowe lub komórki zwojowe siatkówki, staną się wrażliwe na światło.

Optogenetyka została wykorzystana do przywrócenia wrażliwości na światło komórkom czopkowym (zielony) w mysim modelu retinitis pigmentosa; sukces techniki został oceniony poprzez pomiar aktywności komórki zwojowej siatkówki (magenta), która jest stymulowana przez czopki w odpowiedzi na światło.Credit: IOB.ch
Problematycznie jednak, podczas gdy komórki fotoreceptorowe w oku radzą sobie z szerokim zakresem intensywności światła – działając dobrze zarówno w jasnym świetle słonecznym, jak i w półmroku – opsyny mają ograniczony zakres i często działają lepiej przy wysokich intensywnościach światła. Potencjalnym rozwiązaniem jest zastosowanie układu działającego podobnie do systemu bionicznego oka Prima firmy Pixium Vision, w którym odbiorcy są wyposażeni w okulary zawierające kamerę wideo rejestrującą widok użytkownika oraz projektor skierowany na jego oko. Podobnie jak w przypadku Primy, zaletą jest to, że charakter światła, które dostaje się do oka, może być dostosowany do modyfikacji siatkówki; jednak w tym przypadku wybrano natężenie i długość fali, które najlepiej napędzają nowo wprowadzone opsyny, a nie wszczepione fotodiody.
GenSight Biologics, firma biotechnologiczna z Paryża, której założycielami są Sahel i Roska, już testuje taki system. Jej celem jest dostarczenie opsyny do komórek zwojowych siatkówki, ale istnieje potencjalna przeszkoda: komórki zwojowe siatkówki są naturalnie wrażliwe na światło. Wykazują one ekspresję melanopsyny, białka biorącego udział w odruchu źrenicznym, w którym źrenica oka zwęża się w odpowiedzi na jasne światło. Aby tego uniknąć, naukowcy z GenSight używają opsyny, która reaguje na czerwone długości fal świetlnych, ponieważ melanopsyna reaguje preferencyjnie na światło z niebieskiego końca widma. Firma rozpoczęła wczesną fazę badania klinicznego w październiku 2018 r. u osób z zaawansowanym zapaleniem barwnikowym siatkówki, u których pozostał minimalny wzrok. W badaniu wezmą udział kohorty z Wielkiej Brytanii, Francji i Stanów Zjednoczonych, a wstępne wyniki spodziewane są do końca 2020 r.
„To proste podejście i będziemy musieli zobaczyć, co zostanie zyskane” – mówi Roska. „Następnie, możemy przejść do bardziej i bardziej wyrafinowanych podejść”. Jednym z problemów, który pozostaje jest to, że wiele zaburzeń, które techniki optogenetyczne mogą leczyć obejmują degenerację konkretnych części siatkówki, z użytecznym widzeniem zachowanym w innych obszarach. Światło, które napędza opsyny jest widoczne i może zakłócać pozostałe naturalne widzenie. W przyszłości opsyny, które reagują na światło bliskie podczerwieni, mogą umożliwić optogenetyce pracę w parze z pozostałym naturalnym widzeniem.
Regeneracja komórek
Terapia komórkami macierzystymi mogłaby potencjalnie leczyć ślepotę nawet w późnych stadiach choroby. Ponieważ komórki macierzyste można zmusić do przekształcenia się w dowolny typ komórki, można by je wykorzystać do wyhodowania świeżych komórek siatkówki do przeszczepu do oka w celu zastąpienia tych, które zostały utracone. Badania na zwierzętach wykazały jednak, że tylko niewielka część przeszczepionych neuronów jest w stanie prawidłowo zintegrować się ze złożonymi obwodami neuronowymi siatkówki. Stanowi to poważną przeszkodę dla terapii komórkami macierzystymi, które mają na celu zastąpienie neuronów siatkówki.

Złożona struktura komórkowa siatkówki obejmuje warstwy fotoreceptorów (zielony) oraz naczynia krwionośne i nerwy (magenta).Credit: Louise Hughes/SPL
Komórki tworzące nabłonek pigmentowy siatkówki, z drugiej strony, znajdują się poza jej obwodami. Dlatego terapie oparte na komórkach macierzystych są najbardziej obiecujące w przypadku schorzeń, takich jak AMD i retinitis pigmentosa, które powodują degenerację komórek RPE. „Fotoreceptory muszą łączyć się z obwodami, ale nabłonek pigmentu siatkówki nie”, mówi Roska. „To właśnie tam ludzie są najbliżej dokonania postępu”. Początkowo badacze próbowali wstrzykiwać do siatkówki komórki RPE pochodzące z komórek macierzystych w zawiesinie, ale zbyt mało z nich utknęło tam, gdzie były potrzebne. Kilka zespołów uważa obecnie, że lepszym podejściem jest przeszczepianie komórek RPE do oka w postaci wstępnie uformowanego arkusza, który jest następnie utrzymywany w miejscu przez biokompatybilne rusztowanie. „Podejście do rusztowania jest ogromną poprawą, w porównaniu do zawieszenia, dla komórek RPE”, mówi Sahel.
W marcu 2018 r., London Project to Cure Blindness – współpraca między University College London i Moorfields Eye Hospital w Londynie – ogłosił wyniki badania fazy I, w którym arkusz komórek RPE został wszczepiony do siatkówki dwóch osób z mokrym AMD (rzadka, poważna forma AMD obejmująca nieprawidłowy wzrost i wyciek naczyń krwionośnych). Obie osoby dobrze tolerowały zabieg i były w stanie odczytać o 21-29 liter więcej na wykresie czytania niż przed leczeniem12. W następnym miesiącu zespół kierowany przez Humayuna poinformował o podobnych wynikach fazy I u pięciu osób z suchą postacią AMD, bardziej powszechną formą tego schorzenia13. Te wstępne wyniki są bardzo obiecujące. „Doprowadziło to do dużego podekscytowania” – mówi Humayun. Wyniki muszą jednak zostać potwierdzone w badaniach III fazy na większej liczbie uczestników, a Humayun ostrzega, że terapia może być o wiele lat od zastosowania w klinice, ponieważ żadna terapia komórkami macierzystymi w zaburzeniach siatkówki nie przeszła jeszcze przez proces zatwierdzania.
Podobne podejście, wciąż na wczesnym etapie badań podstawowych, może spełnić nadzieję na zastąpienie utraconych neuronów, otwierając drzwi do leczenia szerokiej gamy chorób oczu. U ludzi dojrzałe neurony nie dzielą się i dlatego nie mogą się regenerować, co sprawia, że przywrócenie wzroku jest szczególnie trudne. Nie jest to jednak prawdą w przypadku wszystkich zwierząt. Gady i niektóre ryby potrafią regenerować neurony siatkówki, a ptaki również wykazują pewne zdolności regeneracyjne. Thomas Reh, neurobiolog z University of Washington w Seattle, próbuje odblokować tę zdolność u ludzi. Zamiast jednak przeszczepiać komórki wyhodowane w laboratorium, Reh zamierza zmusić komórki, które już znajdują się w siatkówce, do różnicowania się w świeże neurony.
W 2001 roku Reh zasugerował, że źródłem nowych neuronów, które zaobserwowano u ryb i ptaków, są glejaki Müllera – komórki zapewniające strukturę siatkówki i wspierające jej funkcjonowanie14. On i jego zespół postanowili sprawdzić, czy glia Müllera może być wykorzystana do generowania nowych neuronów u myszy. W 2015 r. zmodyfikowali myszy tak, by wytwarzały Ascl1, białko ważne dla produkcji neuronów u ryb, a następnie uszkodzili siatkówki tych zwierząt15. Mieli nadzieję, że Ascl1 sprowokuje glejaki Müllera do przekształcenia się w neurony.
Eksperyment nie powiódł się w produkcji nowych neuronów u dorosłych myszy, ale powiódł się u młodych myszy. Nikolas Jorstad, biochemik i doktorant w zespole Rehsa, zaproponował, że modyfikacje chemiczne dokonywane w chromatynie (kompleks DNA, RNA i białek) w jądrze komórkowym podczas rozwoju mogą blokować dostęp w dojrzałych komórkach do genów, które umożliwiają przekształcanie się glejaków Müllera w neurony. W sierpniu 2017 r. zespół Reha wykazał, że wprowadzając enzym, który odwraca takie modyfikacje, mógł nakłonić glię Müllera do różnicowania16. „Po raz pierwszy mogliśmy zregenerować neurony u dorosłej myszy” – mówi Reh. „Po tych wszystkich latach byłem zachwycony”. Chociaż nie były to prawdziwe komórki fotoreceptorowe, a wyglądały bardziej jak komórki dwubiegunowe, neurony połączyły się z istniejącymi obwodami i były wrażliwe na światło. „Byłem zaskoczony, że łączą się tak dobrze, jak to robią”, mówi Reh.
Ale choć daleko im do gotowości do leczenia zaburzeń siatkówki u ludzi, praca ma ogromny potencjał. Następnym krokiem będzie powtórzenie badań na zwierzętach, których oczy są bardziej podobne do ludzkich. Zespół Reh’a pracuje już z kulturami komórek siatkówki pochodzącymi od ssaków naczelnych. Naukowcy muszą również opracować sposób kierowania procesem różnicowania w celu wytworzenia określonych typów komórek, takich jak pręciki i czopki. „Teraz mamy nogę w biznesie tworzenia neuronów, czopki byłyby świetne,” mówi Reh.
Jeśli się powiedzie, podejście może być szeroko stosowane. „Ostatecznie, będzie to sposób leczenia wszystkich tych chorób oczu,” przewiduje Reh. „To po prostu ma sens. Nie musisz się martwić o przeszczepy w prawo. Twoje komórki są dokładnie tam, gdzie ich potrzebujesz.”
Humayun jest również zachęcony tą pracą. „Kibicuję każdemu, kto ma nowy, dobry pomysł” – mówi. „Jest bardzo wcześnie, jest wysokie ryzyko, ale nigdy nie mów nigdy. Tego właśnie się nauczyłem.”