Daratumumab (DARA) jest lekiem, który został niedawno zatwierdzony przez FDA i opatentowany przez firmę Janssen do leczenia szpiczaka mnogiego. Lek ten jest przeciwciałem monoklonalnym (MoAb) ukierunkowanym na lgG1k CD38, który ulega ekspresji w komórkach szpiczaka; wykazuje on wysoką cytotoksyczność w stosunku do komórek nowotworowych u tych pacjentów.1-4 Obecność antygenu CD38 na powierzchni erytrocytów osób zdrowych została również potwierdzona za pomocą cytometrii przepływowej.5. Dodatkowo w osoczu chorych leczonych DARA wykryto panreaktywność w rutynowych testach zgodności.6 Jest to nowy problem w medycynie transfuzjologicznej, który opóźnia terminowe dostarczenie składników krwi, stanowiąc potencjalne zagrożenie dla życia chorego. Podręczniki procedur technicznych (np. AABB), jako temat, który pojawił się niedawno, nie przewidują szczególnej metodologii rozwiązywania tego typu problemów.
Od ponad 20 lat krwinki czerwone poddawane działaniu środka redoks – ditiothreitolu (DDT) są powszechnie stosowane w celu denaturacji antygenu Kell, a także innych mniej istotnych klinicznie grup antygenów w wyniku hemolitycznej reakcji poprzetoczeniowej. Widzimy to na przykładzie przypadków Landsteiner-Wiener, Cartwright, Dombrock, Indian, Jhon Milton Hagen, Lutheran i Raph. Cecha ta jest przydatna w badaniach nad alloprzeciwciałami (podręcznik techniczny AABB).7,8
Ostatnio udowodniono, że antygen CD38 jest również wrażliwy na denaturację przez czynnik redoks ditiotreitol (DDT),9 bez wpływu na pozostałe istotne klinicznie antygeny erytrocytów. Wśród możliwości eliminacji zakłóceń stosujemy technikę DTT, która pozwala wykryć obecność klinicznie istotnych przeciwciał, dostarczając w ten sposób składniki krwi o niższym ryzyku transfuzji dla pacjenta.
Materiały i metody
Bank krwi w szpitalu Zambrano Hellion otrzymał prośbę o przetoczenie 2 jednostek pakietów globularnych i 4 koncentratów płytkowych. Pacjent, 64-letni mężczyzna bez przetoczeń w przeszłości, miał rozpoznanego szpiczaka mnogiego z 4-letnią ewolucją i był oporny na konwencjonalne leczenie. Krew żylną pobierano metodą EDTA. Próbki poddano rutynowym badaniom przedtransfuzyjnym przy użyciu konwencjonalnych metod i technik stosowanych w banku krwi (tj. techniki mikroaglutynacji w żelu). Badania grup krwi ABO i Rh wykonano przy użyciu kart Grifols.
Do nieregularnego śledzenia i identyfikacji przeciwciał wykorzystano kompletny panel erytrocytów Grifols oraz kolumny Grifols DG Gel Coombs. Dodatkowo, przedtransfuzyjne testy krzyżowe były przetwarzane zgodnie z techniką opisaną we wkładce DG Coombs (antyludzka globulina polispecyficzna), do traktowania erytrocytów ditiotreitolem (DTT) w stężeniu 0,2M, pH 8, wykorzystując 4.6 metody z podręcznika technicznego ABB (12 wydanie działów ogólnych metod laboratoryjnych)8 (patrz Rys. 1).
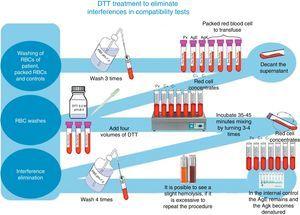
Obróbka DTT w celu wyeliminowania interferencji w testach zgodności.
Wyniki
Osocze pacjenta prezentowało pan-reaktywność z erytrocytami panelu i znanymi antygenami, które wykazywały wzór reakcji o intensywności 3+ (stopień 0-4) homogennie (patrz Rys. 2).
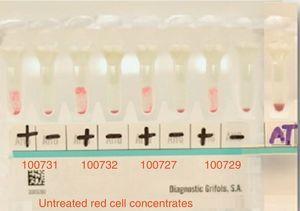
Main cross matching test with 4 donors resulted in incompatibility. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
The main cross-matching test resulted in incompatibility with all studied donors (15 in total).
The patient’s erythrocytes presented a negative direct anti-human globulin test (IgG and C3b), as well as a negative control. The presence of hemolysis in the patient’s sample was not detected (see Fig. 3).

Results direct anti-human globulin test (IgG and C3b) presenting negative results.
W momencie przeprowadzania badań z osoczem pacjenta oraz erytrocytami poddanymi wcześniej działaniu DTT od różnych dawców, jak również użytymi w panelu przesiewowym przeciwciał, nie stwierdziliśmy reaktywności w żadnej z badanych próbek. Erytrocyty kontrolne K+ i E+ zostały użyte w celu sprawdzenia, czy DTT denaturował tylko antygen K i zachował antygen E; była to część kontroli jakości naszego badania w celu ustalenia, że inne antygeny związane z klinicznie istotnymi przeciwciałami były nieaktywne (patrz Ryc. 4).

Panel przesiewowy przeciwciał erytrocyty DTT threated, wykazujący ujemne wyniki u 4 dawców krwi. C1 (kontrola dodatnia) C2 (kontrola ujemna).
Dyskusja
Zastosowanie leku anty-CD38 jest obiecującą metodą leczenia pacjentów ze szpiczakiem mnogim i jest obecnie badane pod kątem innych typów nowotworów złośliwych. Problemem jest to, że lek ten zakłóca testy zgodności, komplikując w ten sposób terminowe i bezpieczne dostarczanie składników krwi.
Istnieją dowody na to, że anty-CD38 w surowicy pacjentów leczonych lekiem DARA wiąże się z antygenem CD38 wyrażonym w erytrocytach wykorzystywanych w panelu śledzenia przeciwciał, jak również w dawcach w teście krzyżowym przed transfuzją, generując pan-reaktywność. Może to maskować obecność klinicznie istotnych przeciwciał, szczególnie u pacjentów wielopłodowych lub pacjentów poddawanych wielokrotnej transfuzji. Ta pan-reaktywność może być odwrócona przez zastosowanie środków neutralizujących, które przywracają prawidłową identyfikację przeciwciał i testy śledzenia. Przeciwciała antyidiotypowe, jak również rozpuszczalne rekombinowane CD38, zostały ocenione w poprzednich artykułach z pozytywnymi wynikami.
Z dostępnych możliwości wyeliminowania tego zakłócenia w banku krwi, użyliśmy techniki DDT. Jej najlepszą cechą jest fakt, że jest to czynnik redoks, który przerywa strukturę trzeciorzędową białka poprzez nieodwracalną redukcję połączeń disulfidowych do wolnego sulfhydrylu. Bez struktury trzeciorzędowej, antygeny, które zawierają białko, nie mogą już wiązać przeciwciał, hamując w ten sposób reaktywność serologiczną. Potencjalnym problemem tej techniki jest to, że wpływa ona również na inne antygeny grup krwi. Jednakże, w codziennej praktyce tylko antygen K ma znaczenie kliniczne. Dlatego zaleca się, aby pacjentom leczonym preparatem DARA przetaczać wyłącznie koncentraty erytrocytów z antygenem K. Istnieje również możliwość utraty reaktywności na inne czynniki, takie jak K i Yta. Okazuje się jednak, że jest to niezwykle rzadkie zjawisko. DDT nie dezaktywuje aktywności serologicznej większości istotnych klinicznie i często występujących antygenów, takich jak układ Rh, Duffy, Kidd i MNS. Rozsądne jest określenie fenotypu lub genotypu pacjenta przed rozpoczęciem leczenia preparatem DARA.
W immunohematologii istnieje obawa o możliwy wzrost tego typu zakłóceń w rutynowych badaniach transfuzji krwi, które mogą pojawić się jako konsekwencja nowych terapii przeciwciałami monoklonalnymi u pacjentów z nowotworami.
Podsumowując, w naszym badaniu wykazaliśmy, że traktowanie erytrocytów za pomocą DTT inaktywuje antygen CD38, eliminując reaktywność z surowicą pacjenta leczonego preparatem DARA. Ta prosta i praktyczna metoda pozwala na przeprowadzenie badań bez zakłóceń, jakie obecność alloprzeciwciał może powodować w reakcjach poprzetoczeniowych u pacjentów leczonych tym przeciwciałem monoklonalnym.
Problem panreaktywności, który powoduje zakłócenia w testach zgodności u pacjentów leczonych DARA, może być technicznie rozwiązany poprzez traktowanie erytrocytów DTT od potencjalnych dawców krwi. Środek ten dezaktywuje antygen CD38 obecny w tych komórkach. Ta panreaktywność nie powinna opóźniać dostarczania preparatów krwiopochodnych, które w sytuacjach nagłych będą wykorzystywać identyczne zestawy globulin ABO i krwinek czerwonych zgodnych z układem Rh, zgodnie z praktyką banku krwi. Zmusza to do opracowania zaleceń i/lub przewodników dla lekarzy prowadzących leczenie i pracowników banków krwi, którzy zajmują się tego typu pacjentami. Należy podkreślić, że dotychczas nie obserwowano hemolitycznych reakcji poprzetoczeniowych u około 2000 chorych leczonych preparatem DARA.8 W ostatnich badaniach nad bezpieczeństwem przetoczeń u chorych leczonych preparatem DARA obejmujących około 76 000 cykli stosowania leku nie stwierdzono ani jednej niepożądanej reakcji poprzetoczeniowej w postaci hemolizy.10-12
Wspólna praca onkohematologa i banku krwi musi być obecna od momentu przyjęcia chorego do szpitala. Procedury transfuzji stosowane u tego typu pacjentów powinny obejmować identyfikację pełnego fenotypu erytrocytu z pudełka z jego grupą krwi, a próby zgodności powinny być wykonywane w miarę naszych możliwości przed zastosowaniem tego leku.
Opisana powyżej technika dezaktywacji DTT stanowi alternatywną miarę bezpieczeństwa transfuzji we wszystkich przypadkach. Nasz bank krwi jest pionierem w naszym kraju w stosowaniu tej niedawno opisanej i zwalidowanej na arenie międzynarodowej technologii.13 Jednak w krytycznych sytuacjach nagłych transfuzji, gdy życie pacjenta jest zagrożone, krew powinna być przetaczana tylko w przypadku zgodności ABO i RhD, bez wykonywania prób zgodności zgodnie z zasadami i procedurami wcześniej opisanymi w transfuzjach w nagłych przypadkach.
Konflikt interesówAutorzy nie mają konfliktu interesów do zgłoszenia.