Identifiera materiens byggstenar
På sin mest grundläggande nivå består livet av materia. Materia är alla ämnen som upptar utrymme och har massa. Grundämnen är unika former av materia med specifika kemiska och fysiska egenskaper som inte kan brytas ner till mindre ämnen genom vanliga kemiska reaktioner. Det finns 118 grundämnen, men endast 92 förekommer naturligt. De återstående grundämnena syntetiseras i laboratorier och är instabila.
Varje grundämne betecknas med sin kemiska symbol, som är en enda stor bokstav eller, när den första bokstaven redan är ”upptagen” av ett annat grundämne, en kombination av två bokstäver. Vissa grundämnen följer den engelska termen för grundämnet, till exempel C för kol och Ca för kalcium. Andra grundämnens kemiska symboler härstammar från deras latinska namn, till exempel är symbolen för natrium Na, som hänvisar till natrium, det latinska ordet för natrium.
De fyra grundämnen som är gemensamma för alla levande organismer är syre (O), kol (C), väte (H) och kväve (N). I den icke-levande världen finns grundämnena i olika proportioner, och vissa grundämnen som är gemensamma för levande organismer är relativt sällsynta på jorden som helhet, vilket framgår av tabell 1. Atmosfären är till exempel rik på kväve och syre men innehåller lite kol och väte, medan jordskorpan, även om den innehåller syre och en liten mängd väte, har lite kväve och kol. Trots skillnaderna i förekomst följer alla grundämnen och de kemiska reaktionerna mellan dem samma kemiska och fysikaliska lagar oavsett om de ingår i den levande eller icke levande världen.
| Tabell 1. Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, och hur dessa faktorer påverkar bindningsbildningen mellan atomer
Atomer
Atomens uppbyggnad
För att förstå hur grundämnena sätts samman måste vi först diskutera den minsta komponenten eller byggstenen i ett grundämne, atomen. En atom är den minsta materienhet som behåller alla kemiska egenskaper hos ett grundämne. Till exempel har en guldatom alla egenskaper hos guld genom att den är en fast metall vid rumstemperatur. Ett guldmynt är helt enkelt ett mycket stort antal guldatomer som är gjutna i form av ett mynt och som innehåller små mängder av andra grundämnen, så kallade föroreningar. Guldatomer kan inte brytas ner till något mindre samtidigt som de behåller guldets egenskaper.
En atom består av två områden: kärnan, som befinner sig i mitten av atomen och innehåller protoner och neutroner, och det yttersta området av atomen som håller sina elektroner i en omloppsbana runt kärnan, vilket illustreras i figur 1. Atomer innehåller protoner, elektroner och neutroner, bland andra subatomära partiklar. Det enda undantaget är väte (H), som består av en proton och en elektron utan neutroner.

Figur 1. Grundämnen, till exempel helium som avbildas här, består av atomer. Atomer består av protoner och neutroner som befinner sig i kärnan, med elektroner i orbitaler som omger kärnan.
Protoner och neutroner har ungefär samma massa, cirka 1,67 × 10-24 gram. Forskare definierar godtyckligt denna mängd massa som en atommassenhet (amu) eller en dalton, enligt tabell 1. Även om protoner och neutroner är lika i massa skiljer de sig åt genom sin elektriska laddning. En proton är positivt laddad medan en neutron är oladdad. Därför bidrar antalet neutroner i en atom avsevärt till dess massa, men inte till dess laddning. Elektroner har en mycket mindre massa än protoner och väger endast 9,11 × 10-28 gram, eller ungefär 1/1800 av en atommasseenhet. Därför bidrar de inte mycket till ett grundämnes totala atommassa. När det gäller atommassa är det därför vanligt att ignorera massan av eventuella elektroner och beräkna atomens massa enbart utifrån antalet protoner och neutroner. Även om elektronerna inte bidrar till massan i någon större utsträckning, bidrar de i hög grad till atomens laddning, eftersom varje elektron har en negativ laddning som är lika stor som protonens positiva laddning. I oladdade, neutrala atomer är antalet elektroner som kretsar runt kärnan lika med antalet protoner i kärnan. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | Nukleus |
| Elektron | -1 | 0 | orbitaler |
Atomnummer och massa
Atomerna i varje grundämne innehåller ett karakteristiskt antal protoner och elektroner. Antalet protoner bestämmer ett grundämnes atomnummer och används för att skilja ett grundämne från ett annat. Antalet neutroner är variabelt, vilket resulterar i isotoper, som är olika former av samma atom som endast varierar i det antal neutroner de har. Tillsammans bestämmer antalet protoner och antalet neutroner ett grundämnes masstal, vilket illustreras i figur 2. Observera att det lilla bidraget av massa från elektroner inte beaktas vid beräkningen av masstalet. Denna approximation av massan kan användas för att enkelt beräkna hur många neutroner ett grundämne har genom att helt enkelt subtrahera antalet protoner från masstalet. Eftersom ett grundämnes isotoper kommer att ha något olika masstal, bestämmer forskarna också atommassan, som är det beräknade medelvärdet av masstalet för dess naturligt förekommande isotoper. Ofta innehåller det resulterande talet en bråkdel. Till exempel är atommassan för klor (Cl) 35,45 eftersom klor består av flera isotoper, en del (majoriteten) med atommassa 35 (17 protoner och 18 neutroner) och en del med atommassa 37 (17 protoner och 20 neutroner).
Praktikfråga
Kol har atomnumret sex och två stabila isotoper med masstal på tolv respektive tretton. Dess atommassa är 12,11.

Figur 2. Kol-12 och kol-13
Hur många neutroner har kol-12 respektive kol-13?
Det periodiska systemet för grundämnen
De olika grundämnena är organiserade och visas i det periodiska systemet. Det är en idé som utarbetades av den ryske kemisten Dmitri Mendelejev (1834-1907) år 1869 och som grupperar grundämnen som, även om de är unika, delar vissa kemiska egenskaper med andra grundämnen. Grundämnenas egenskaper är ansvariga för deras fysiska tillstånd vid rumstemperatur: de kan vara gaser, fasta ämnen eller vätskor. Elementen har också en specifik kemisk reaktivitet, dvs. förmågan att kombinera och kemiskt binda sig med varandra.
I det periodiska systemet, som visas i figur 3, organiseras och visas elementen i enlighet med deras atomnummer och är ordnade i en serie rader och kolumner baserat på gemensamma kemiska och fysikaliska egenskaper. Förutom att ange atomnumret för varje grundämne visar det periodiska systemet också grundämnets atommassa. Om man till exempel tittar på kol visas dess symbol (C) och namn, liksom dess atomnummer på sex (i övre vänstra hörnet) och dess atommassa på 12,11.

Figur 3. Det periodiska systemet visar varje grundämnes atommassa och atomnummer. Atomnumret visas ovanför symbolen för grundämnet och den ungefärliga atommassan visas nedanför.
Det periodiska systemet grupperar grundämnena enligt kemiska egenskaper. Skillnaderna i kemisk reaktivitet mellan grundämnena bygger på antalet och den rumsliga fördelningen av atomens elektroner. Atomer som reagerar kemiskt och binder sig till varandra bildar molekyler. Molekyler är helt enkelt två eller flera atomer som är kemiskt bundna till varandra. När två atomer binder sig kemiskt för att bilda en molekyl är det logiskt sett så att deras elektroner, som utgör den yttersta delen av varje atom, kommer samman först när atomerna bildar en kemisk bindning.
Se den här videon för en mer djupgående introduktion till det periodiska systemet:
Elektroner
Elektronskal och Bohrmodellen

Figur 4. Bohrmodellen.
Det bör betonas att det finns ett samband mellan antalet protoner i ett grundämne, atomnumret som skiljer ett grundämne från ett annat, och antalet elektroner det har. I alla elektriskt neutrala atomer är antalet elektroner detsamma som antalet protoner. Således har varje grundämne, åtminstone när det är elektriskt neutralt, ett karakteristiskt antal elektroner som är lika med dess atomnummer.
En tidig modell av atomen utvecklades 1913 av den danske vetenskapsmannen Niels Bohr (1885-1962). I denna modell existerar elektronerna i huvudskal. En elektron finns normalt i det skal med lägst energi som finns tillgängligt, vilket är det som ligger närmast kärnan. Energi från en ljusfoton kan föra upp den till ett skal med högre energi, men denna situation är instabil och elektronen sönderfaller snabbt tillbaka till grundtillståndet. I processen frigörs en ljusfoton.
Berrs modell visar atomen som en central kärna som innehåller protoner och neutroner, med elektronerna i cirkulära banor på specifika avstånd från kärnan, vilket illustreras i figur 4. Dessa banor bildar elektronskal eller energinivåer, som är ett sätt att visualisera antalet elektroner i de yttersta skalen. Dessa energinivåer betecknas med ett nummer och symbolen ”n”. Till exempel representerar 1n den första energinivån som ligger närmast kärnan.
Elektronerna fyller banor i en konsekvent ordning: de fyller först de banor som ligger närmast kärnan, sedan fortsätter de att fylla banor med ökande energi längre bort från kärnan. Om det finns flera orbitaler med samma energi kommer de att fyllas med en elektron i varje energinivå innan en andra elektron läggs till. Elektronerna i den yttersta energinivån bestämmer atomens energistabilitet och dess tendens att bilda kemiska bindningar med andra atomer för att bilda molekyler.
Under standardförhållanden fyller atomerna de inre skalen först, vilket ofta resulterar i ett varierande antal elektroner i det yttersta skalet. Det innersta skalet har högst två elektroner, men de två följande elektronskalen kan vardera ha högst åtta elektroner. Detta är känt som oktettregeln, som säger, med undantag för det innersta skalet, att atomer är mer stabila energimässigt när de har åtta elektroner i sitt valensskal, det yttersta elektronskalet. Exempel på några neutrala atomer och deras elektronkonfigurationer visas i figur 5. Lägg märke till att helium i denna figur har ett komplett yttre elektronskal, med två elektroner som fyller det första och enda skalet. På samma sätt har neon ett fullständigt yttre 2n-skal som innehåller åtta elektroner. Däremot har klor och natrium sju respektive en i sina yttre skal, men teoretiskt sett skulle de vara mer energimässigt stabila om de följde oktettregeln och hade åtta.
Praktikfråga
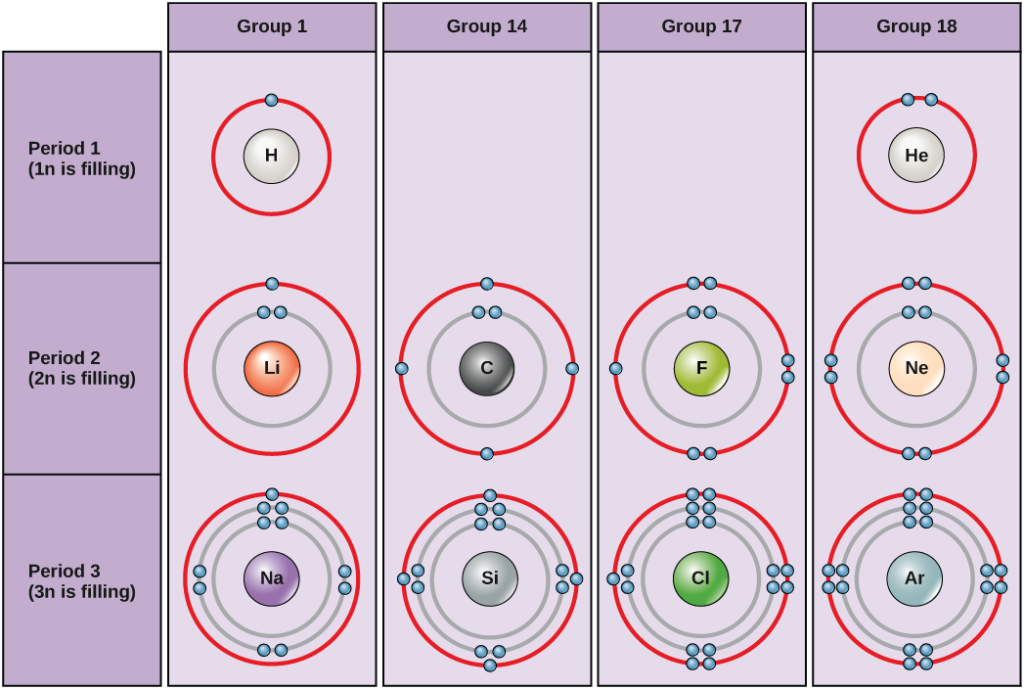
Figur 5. Bohrdiagram för väte, helium, litium, kol, fluor, neon, natrium, kisel, klor och argon.
Bohrdiagrammen anger hur många elektroner som fyller varje huvudskal. Elementen i grupp 18 (helium, neon och argon visas i figur 5) har ett fullt yttre skal, eller valensskal. Ett fullt valensskal är den mest stabila elektronkonfigurationen. Element i andra grupper har delvis fyllda valensskal och får eller förlorar elektroner för att uppnå en stabil elektronkonfiguration.
En atom kan ge, ta eller dela elektroner med en annan atom för att uppnå ett fullt valensskal, den mest stabila elektronkonfigurationen. Om du tittar på figuren, hur många elektroner måste grundämnena i grupp 1 förlora för att uppnå en stabil elektronkonfiguration? Hur många elektroner måste grundämnena i grupperna 14 och 17 ta till sig för att uppnå en stabil konfiguration?
Om vi förstår att det periodiska systemets organisation bygger på det totala antalet protoner (och elektroner) kan vi lättare förstå hur elektronerna fördelas i det yttre skalet. Det periodiska systemet är ordnat i kolumner och rader baserat på antalet elektroner och var dessa elektroner är placerade. Titta närmare på några av grundämnena i det periodiska systemets kolumn längst till höger i figur 3.
Atomerna i grupp 18 helium (He), neon (Ne) och argon (Ar) har alla fyllda yttre elektronskal, vilket gör att de inte behöver dela elektroner med andra atomer för att uppnå stabilitet; de är mycket stabila som enskilda atomer. Deras icke-reaktivitet har resulterat i att de kallas inerta gaser (eller ädelgaser). Jämför detta med grundämnena i grupp 1 i den vänstra kolumnen. Dessa grundämnen, inklusive väte (H), litium (Li) och natrium (Na), har alla en elektron i sina yttersta skal. Det innebär att de kan uppnå en stabil konfiguration och ett fyllt yttre skal genom att donera eller dela en elektron med en annan atom eller en molekyl som t.ex. vatten. Vätgas kommer att donera eller dela sin elektron för att uppnå denna konfiguration, medan litium och natrium kommer att donera sin elektron för att bli stabila. När de förlorar en negativt laddad elektron blir de positivt laddade joner. Grundämnen i grupp 17, däribland fluor och klor, har sju elektroner i sina yttersta skal, så de tenderar att fylla detta skal med en elektron från andra atomer eller molekyler, vilket gör dem till negativt laddade joner. Elementen i grupp 14, av vilka kol är det viktigaste för levande system, har fyra elektroner i sitt yttersta skal, vilket gör att de kan göra flera kovalenta bindningar (som diskuteras nedan) med andra atomer. Kolumnerna i det periodiska systemet representerar således det potentiella delade tillståndet i dessa grundämnenas yttre elektronskal som är ansvarigt för deras liknande kemiska egenskaper.
Elektronorbitaler
Och även om den är användbar för att förklara vissa grundämnens reaktivitet och kemiska bindningar, återspeglar Bohrs atommodell av atomen inte exakt hur elektronerna är rumsligt fördelade runt kärnan. De kretsar inte runt kärnan som jorden kretsar runt solen, utan befinner sig i elektronbanor. Dessa relativt komplexa former beror på att elektroner inte bara beter sig som partiklar utan också som vågor. Matematiska ekvationer från kvantmekaniken, så kallade vågfunktioner, kan med en viss grad av sannolikhet förutsäga var en elektron kan befinna sig vid en viss tidpunkt. Det område där en elektron med största sannolikhet befinner sig kallas för dess orbital.

Figur 6. Klicka för en större bild. S-underskalen är formade som sfärer. Både 1n- och 2n-huvudskalet har en s-orbital, men sfärens storlek är större i 2n-orbitalet. Varje sfär är en enda orbital. p-subskal består av tre hantelformade orbitaler. Huvudskalet 2n har ett p-underskal, men inte skal 1.
Hålls i minnet att Bohrmodellen skildrar en atoms elektronskalkonfiguration. Inom varje elektronskal finns underskal, och varje underskal har ett specificerat antal orbitaler som innehåller elektroner. Även om det är omöjligt att beräkna exakt var en elektron befinner sig vet forskarna att den med största sannolikhet befinner sig inom sin banbana. Delskal betecknas med bokstäverna s, p, d och f. Delskalet s är sfäriskt till formen och har en orbital. Huvudskalet 1n har endast en enda s-orbital, som kan rymma två elektroner. Huvudskal 2n har ett s- och ett p-subskal och kan innehålla totalt åtta elektroner. P-subskalet har tre hantelformade orbitaler, vilket illustreras i figur 6. Underskal d och f har mer komplexa former och innehåller fem respektive sju orbitaler. Dessa visas inte i illustrationen. Huvudskal 3n har s-, p- och d-underskal och kan innehålla 18 elektroner. Huvudskal 4n har s-, p-, d- och f-orbitaler och kan innehålla 32 elektroner. När man rör sig bort från kärnan ökar antalet elektroner och orbitaler som finns i energinivåerna. Om man går från en atom till nästa i det periodiska systemet kan man räkna ut elektronstrukturen genom att passa in en extra elektron i nästa tillgängliga orbital.
Den närmaste orbitalen till kärnan, kallad 1s orbital, kan rymma upp till två elektroner. Denna orbit motsvarar det innersta elektronskalet i Bohrs modell av atomen. Den kallas 1s orbital eftersom den är sfärisk runt kärnan. 1s-blocket är det som ligger närmast kärnan, och det fylls alltid först, innan något annat bälte kan fyllas. Vätgas har en elektron; därför har den bara en plats i 1s-borgitalet som är upptagen. Detta betecknas som 1s1, där den översatta 1:an hänvisar till den enda elektronen i 1s-boplatsen. Helium har två elektroner och kan därför helt fylla 1s-bitalet med sina två elektroner. Detta betecknas som 1s2, vilket hänvisar till heliums två elektroner i 1s-bitalet. I figur 6 i det periodiska systemet är väte och helium de enda två grundämnena i den första raden (perioden); detta beror på att de bara har elektroner i sitt första skal, 1s-bitalet. Väte och helium är de enda två grundämnena som har 1s och inga andra elektronorbitaler i det elektriskt neutrala tillståndet.
Det andra elektronskalet kan innehålla åtta elektroner. Detta skal innehåller ytterligare en sfärisk s-orbital och tre ”hantelformade” p-orbitaler, som var och en kan rymma två elektroner, vilket visas i figur 6. Efter det att 1s-bobitalen är fylld fylls det andra elektronhöljet genom att först fylla 2s-bobitalen och sedan de tre p-orbitalerna. När p-orbitalerna fylls tar var och en av dem en enda elektron; när varje p-orbital har en elektron kan en andra läggas till. Litium (Li) innehåller tre elektroner som upptar det första och andra skalet. Två elektroner fyller 1s-bokalen, och den tredje elektronen fyller sedan 2s-bokalen. Dess elektronkonfiguration är 1s22s1. Neon (Ne), å andra sidan, har totalt tio elektroner: två finns i dess innersta 1s-orbital och åtta fyller det andra skalet (två vardera i 2s- och tre p-orbitaler); det är alltså en inert gas och energimässigt stabil som en enskild atom som sällan kommer att bilda en kemisk bindning med andra atomer. Större grundämnen har ytterligare orbitaler som utgör det tredje elektronskalet. Även om begreppen elektronskal och orbitaler är nära besläktade ger orbitaler en mer exakt skildring av en atoms elektronkonfiguration eftersom orbitalmodellen specificerar de olika formerna och de speciella orienteringarna för alla de platser som elektroner kan inta.
Klipp på den här visuella animationen för att se det rumsliga arrangemanget av p- och s-orbitalerna. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.