Introduktion
Två visuella signaler som uppträder samtidigt upptäcks snabbare än en av signalerna som uppträder ensamma (Hershenson, 1962; Raab, 1962). En del av denna redundanta måleffekt (Redundant Target Effect, RTE) kan förklaras stokastiskt av en ”hästkapplöpningsmodell”. Det vill säga, om två stimuli bearbetas i parallella och oberoende kanaler för vilka bearbetningshastigheten varierar slumpmässigt från försök till försök, vinner vid varje presentation det snabbaste stimulet loppet och når detektionströskeln för att utlösa responsen; därför är det i genomsnitt mer sannolikt att två stimuli ger en snabbare respons än den genomsnittliga responstiden för ett stimulus som bearbetas i någon av de två kanalerna.
Analyser av kumulativa frekvensfördelningar har dock visat att det finns ytterligare ett bidrag till RTE som inte kan redovisas av en hästloppsmodell mellan två oberoende kanaler. Miller (1982) föreslog en ”samaktiveringsmodell” där de två signalerna summeras i en aktiveringspool. Miniussi et al. (1998) visade att redundanta mål gav kortare latenstider för P1- och N1-händelserelaterade hjärnpotentialer, vilket tyder på att neuronal summering sker tidigt i den visuella banan. Experiment på hemianopiska patienter har också visat att RTE inte helt och hållet kan förklaras av en hästkapplöpning för att nå upptäcktströskeln, eftersom en RTE kan manifesteras även i avsaknad av fenomenalt medvetande om ett av de två stimuli (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). Hos hemisfärektompatienter genererar ett redundant mål i det blinda fältet faktiskt inte bara en RTE, RTE förstärks när det redundanta stimuluset fullbordar ett gestaltmönster (Georgy et al., 2016). Dessa observationer hos hemianoptiker tyder på att den neurala summeringen sker subkortikalt och inte är beroende av primär visuell cortex.
Den ackumulerade indirekta bevisningen har implicerat superior colliculus (SC) som substratet för den neurala summering som bidrar till RTE. Direkta bevis har dock ännu inte rapporterats. I den aktuella forskningen undersöks den neurala väg som överför de visuella signaler som integreras i SC. SC består av ytliga och djupa lager. De djupa lagren av colliculus tar emot afferenter, både direkt och via basala ganglier, från oculomotorisk cortex (Hikosaka och Wurtz, 1983; Pare och Wurtz, 1997; Sommer och Wurtz, 2000). Visuella afferenter till de ytliga skikten av colliculus överförs dock både från näthinnan (via retino-tectal tract) och från tidig visuell cortex (Fries, 1984), via SC:s brachium.
Då neurala summeringseffekter har påvisats hos neurologiska patienter som saknar visuell cortex, skulle de visuella signaler som summeras i colliculus kunna överföras direkt från näthinnan till de ytliga skikten av colliculus via retino-tectal tract. Om så är fallet skulle neuronal summering kunna upphävas genom skador på SC:s brachium.
Lesioner som stör SC:s brachium är mycket sällsynta. Här rapporterar vi enstaka fallstudier av två patienter med unilaterala subkortikala lesioner som avafferenterade SC från visuell input, och som inte uppvisade någon RTE. Den ena patienten hade en skada som skadade både thalamus pulvinar nucleus, den rostrala SC och dess brachium. Hos den andra patienten, med skador på den dorsala mellanhjärnan från en traumatisk hjärnskada, verkade SC vara intakt, men dess brachium var stört.
Material och metoder
Deltagare
Två neurologiska patienter, var och en med sin egen åldersmatchade kontrollgrupp, testades i ett experiment för att mäta RTE.
RE var 71 år gammal vid tidpunkten för testningen. En bakre thalamisk blödning tre år tidigare förstörde den mediala pulvinaren, de ventro-laterala thalamiska kärnorna och den bakre delen av den inre kapseln med skador som sträckte sig in i den dorsala mellanhjärnan, inklusive pretectum och rostrala SC (figur 1) Probabilistisk DTI-traktografi (Behrens m.fl., 2003, Behrens m.fl., 2007) bekräftade att skadan förstörde SC:s brachium (figur 2). RE var förlamad på vänster sida av kroppen med förlust av känsel i vänster ansikte och arm. Hon hade onormala ögonrörelser inklusive ögonlocksindragning, förlamade vertikala ögonrörelser och försämrad konvergens, vilket var en följd av lesionens utbredning i den dorsala mellanhjärnan.
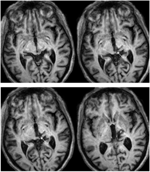
FIGUR 1. Högupplöst (0,7 mm3) T1-viktad MRT av patient RE. Axiala snitt från ventralt (överst till vänster) till dorsalt (nederst till höger) som visar lesionen i den högra dorsala mellanhjärnan och thalamus. Läsionens utbredning i rostral superior colliculus (SC) visas med vita pilar.
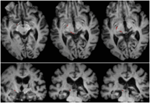
FIGUR 2. Traktografi som visar retinotektalbanan hos patient RE samregistrerad till T1-viktade axiella snitt (överst från ventralt till dorsalt) och koronala snitt (nederst från anteriort till posteriort). Retinotektalbanans förlopp visas i den vänstra hemisfären (rött). Ingen strömlinje kunde spåras i den högra hemisfären och genom jämförelse med den intakta hemisfären kan man se att skadan förstörde SC:s brachium i den högra hemisfären. Den strömlinje som visas i rött genererades med probabilistisk traktografi med hjälp av FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). Diffusionsviktade ekoplanära magnetresonansbilder förvärvades med en upplösning på 1,5 mm3 med 32 isotropt fördelade diffusionskodande riktningar (b = 800) och en baslinje (b = 0). Repetitionstid = 2 s och ekotid = 35 ms. För den probabilistiska traktografin markerade vi manuellt startregionen (dvs. ritade seed-masker) på den optiska banan i varje hemisfär strax bakom chiasman och en målregion (målmask) på SC.
ML var 23 år gammal vid testtillfället. Hon hade drabbats av en allvarlig traumatisk hjärnskada i en trafikolycka 7 år tidigare, vilket resulterade i en diffus axonal skada med blödning i den högra putamenen och den dorsala mellanhjärnan. Detaljer om hennes historia, neurologiska undersökning och fynd av neuroimaging har rapporterats av (Poliva et al., 2015). Även om kvar var vissa motoriska försämringar, inklusive spasticitet och ataxi, hade hon återfått sitt oberoende. Hennes huvudsakliga funktionsnedsättning var allvarlig auditiv agnosi på grund av skador på hjärnstammens auditiva vägar, inklusive den vänstra inferior colliculus. Synskärpa och synfält var opåverkade och det fanns ingen visuell neglect eller extinktion. Oculomotoriska tecken på dysfunktion i mellanhjärnan var bl.a. makrovågsryckningar och konvergensspasmer vid vertikal blick (nedåt mer än uppåt). Högupplöst MRT visade en cystisk kavitet i höger putamen på platsen för hennes tidigare blödning och en liten periventrikulär lesion på höger nedre pons, i området för den nedre cerebellära pedunkeln (figur 3). Hon hade en nästan fullständig avulsion av den vänstra inferior colliculus, och endast de mest mediala och kaudala delarna var sparade. Skadorna sträckte sig in i det laterala pretectum och tegmentum i mellanhjärnan och förstörde den övre och den undre colliculiens brachia, och ventralt in i den röda kärnan. Probabilistisk DTI-traktografi bekräftade att skadan förstörde SC:s brachium (figur 4).
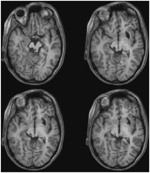
FIGUR 3. Högupplöst (0,7 mm3) T1-viktad MRT av patient ML. Axiala snitt från ventralt (överst till vänster) till dorsalt (nederst till höger) visar skador på vänster inferior colliculus och mesencefaliska tegmentum ventralt och lateralt till SC.
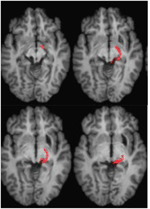
FIGUR 4. DTI-traktografi hos patient ML som visar retino-tektalbanan i den högra hemisfären (röd) samregistrerad med T1-viktade MR-bilder i axialplanet från ventralt (överst till vänster) till dorsalt (nederst till höger). Diffusionsviktade ekoplanära magnetresonansbilder förvärvades med en upplösning på 2 mm3 med 63 isotropt fördelade diffusionskodande riktningar (b = 1000) och en baslinje (b = 0). Repetitionstid = 2 s och ekotid = 35 ms. Traktografi genomfördes enligt beskrivningen i figur 2.
Neurologiskt friska kontrollpersoner för patient RE omfattade 11 äldre vuxna (sex kvinnor och fem män, medelålder: 68,5, intervall 59-73). De rekryterades från Bangor University Community Participant Panel. Deltagarna hade inga kända neurologiska, psykologiska, psykiatriska eller kognitiva funktionsnedsättningar och alla deltagare hade normal/korrigerad till normal syn. Deltagarna fick en betalning på 6 pund för sitt deltagande.
Neurologiskt friska kontrollpersoner för patient ML omfattade 11 studenter och doktorander från Bangor University i åldrarna 18-26 år (sju kvinnor och fyra män).
Apparat och visningsförhållanden
Presentation®-programmeringsprogram som körs på en PC-dator registrerade reaktionstidssvar (RT) och genererade stimuli som presenterades på en Dell-skärm (12,5″ × 25″, uppdateringsfrekvens 60 Hz.) som placerades i ögonhöjd 57 cm framför deltagarna med binokulärt betraktande i dämpat ljus. Ett hak- och huvudstöd användes för att säkerställa huvudets stabilitet. Deltagarnas svar registrerades genom att trycka på mellanslagstangenten på ett tangentbord.
Stimuli
De experimentella stimuli bestod av ofyllda vita markeringsrutor (1 cm × 1 cm) placerade 8° till vänster och höger om en liten fixeringsruta (0,2 cm × 0,2 cm) i mitten av skärmen. Målstimulansen bestod av att fylla i en eller båda de perifera markeringsrutorna för att skapa en solid vit kvadrat. Alla stimuli var vita och presenterades på en grå bakgrund.
Figur 5 visar sekvensen för ett enskilt försök. Markeringsrutorna förblev synliga under hela försöket. Efter ett intervall mellan försöken på 1750 ms visades fixeringsrutan för att starta försöket. Efter ett slumpmässigt intervall på mellan 250 och 750 ms (i steg om 25 ms) dök ett mål som krävde ett enkelt tangenttryck på tangentbordets mellanslag upp på platsen för en eller båda markeringsrutorna. Målet var en fylld vit kvadrat som skapades genom att fylla i en eller båda markeringsrutorna. Slumpmässigt och med samma sannolikhet dök målen upp till vänster, till höger eller båda samtidigt. Inget mål dök upp vid fångstförsök (10 % av försöken).
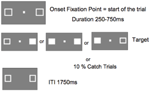
FIGUR 5. Visningssekvens för en enskild prövning (ITI, inter-trialintervall mellan deltagarsvar och start av fixeringspunkten för nästa prövning).
Förfarande
Varje deltagare testades i en enda session. Efter att ha läst instruktionerna på skärmen visades deltagarna exempel på alla stimuli som presenterades i uppgiften (fixeringsrutan och var och en av de tre målpresentationerna) och ombads bekräfta igenkännandet av varje mål genom att trycka på mellanslagstangenten. Instruktionerna gick ut på att bibehålla fixeringen på den centrala rutan under varje försök och att reagera så snabbt som möjligt genom att trycka på mellanslagstangenten på tangentbordet med höger hand så snart ett mål dök upp.
När deltagaren väl bekräftat muntligt och genom att trycka på tangentbordet att han eller hon hade förstått alla instruktioner fortsatte presentationen av övningsförsök (10 av varje målpresentationskondition och 3 försök med mål som inte fanns med, så kallade ”catch”-försök). Återkoppling på skärmen presenterades under slutförandet av övningsförsöken och innehöll följande påståenden: (1) ”Korrekt”, (2) ”Försök att reagera snabbare!” och (3) ”Reagera bara om du ser ett mål”. När övningspasset var avslutat och både deltagaren och försöksledaren var övertygade om att uppgiftsinstruktionerna var korrekt förstådda, uppmanades deltagaren att påbörja experimentet. De första 30 försöken i varje experimentblock uteslöts som övningsförsök. Varje block bestod av totalt 233 försök: 70 försök med höger, 70 försök med vänster, 70 försök med båda och 23 försök med ”fångst”. En kort paus gavs efter halva blocket. Patient ML och de yngre kontrollerna testades i ett enda block. På grund av variationen i samband med patient RE:s ålder och tillstånd testades hon i två block på olika dagar, och hennes åldersmatchade kontrolldeltagare testades också i två sessioner på en och samma dag.
Analyser
För varje kontrollgrupp beräknades median-RT för varje deltagare i varje tillstånd (vänster mål, höger mål, bilaterala mål) efter att ha uteslutit försök som följde på fångstförsök och försök med RTs på <100 ms eller >800 ms. Ett t-test med parat urval gjordes för att bekräfta att det inte fanns någon asymmetri för svaren på höger och vänster unilaterala mål, och en genomsnittlig RT för unilaterala mål beräknades. RTE beräknades genom att subtrahera RT för bilaterala försök från RT för unilaterala försök. Ett parat t-test jämförde unilaterala med bilaterala för att fastställa om RTE var statistiskt tillförlitlig.
För varje patient, efter att ha uteslutit försök efter fångstförsök och försök med RTs på <100 ms eller >800 ms, jämfördes med hjälp av ett parat t-test med median-RTs för contralaterala och ipsilaterala unilaterala mål. Som rapporteras nedan var RTs för svar på contralesionala mål längre än för ipsilionala unilaterala mål. För att avgöra om närvaron av ett kontralesionalt mål gav upphov till en statistiskt tillförlitlig RTE jämfördes med ett parat t-test med median-RTs för bilaterala målförsök med unilaterala ipsilesionala målförsök.
För att testa om RTE:n var tillförlitligt mindre för varje patient än för respektive kontrollgrupp beräknades RTE:n för varje deltagare i kontrollgruppen, och den övre och nedre gränsen för 95-procentiga konfidensintervallet (KI) beräknades. Z-score för varje patients RTE beräknades i förhållande till deras kontrollgrupp och testades för statistisk tillförlitlighet med Crawfords t-test.
P-värden för parade t-test rapporterades för två svansar och för Crawfords t, en svans.
Resultat
Patient RE
Kontrolldeltagare: Figur 6 visar att RTs var kortare (RTE) för bilaterala mål än för antingen vänster (t = 6,8, p < 0,001, eller höger (t1,10) = 3,8, p = 0,003) unilaterala mål. Median RT för bilaterala målförsök subtraherades från median RT för unilaterala mål för att beräkna en genomsnittlig RTE för varje kontrolldeltagare. Kontrollgruppens genomsnittliga RTE var 24,3 ms (SEM = 2,75).

FIGUR 6. Median RTs för patient RE och medelvärdet av median RTs för deltagare i kontrollgruppen för mål i det vänstra synfältet (”Left”), det högra synfältet (”Right”) och samtidigt i båda synfälten (”Both”). Felmarkerna för kontrolldeltagarna anger standardfel.
Patient RE:s median-RT var längre än kontrollerna (figur 6) och låg över den övre gränsen för 95 % KI för kontrollgruppens medel-RT för alla tre förhållanden (vänster = 457 ms; höger = 449 ms; båda = 426 ms). RTs för unilaterala mål i det contralesionella (vänstra) fältet var längre än för unilaterala mål i det ipsilesionella (högra) fältet (t = 6,0, p < 0,001).
Viktigt nog fanns det ingen RTE: Median RT för bilaterala mål (500 ms) var inte kortare än för unilaterala mål i det ipsilesionala (högra) synfältet (494 ms; t = 1,141), p = ns (figur 6). Tabell 1 (överst) visar att den RTE som beräknades för patient RE var signifikant mindre än RTE för hennes kontrollgrupp.

TABELL 1. Redundant måleffekt för patient RE (överst) och ML (nederst) och genomsnittlig RTE för deras respektive kontrollgrupper med 95 % konfidensintervall (CI), Z-poäng och Crawford t-test där varje patient jämförs med sin respektive kontrollgrupp.
Patient ML
Kontrolldeltagare: Medelvärdet av medianen av RTs skiljde sig inte åt för svar på vänster och höger mål (t = 0,86. Figur 7 visar att RTs var kortare (RTE) för bilaterala mål än för antingen vänster (t = 4,7, p = 0,001, eller höger (t1,11) = 7,8, p < 0,001) unilaterala mål.

FIGUR 7. Median RTs för Patient ML och medelvärdet av median RTs för deltagare i kontrollgruppen för mål som förekommer i det vänstra synfältet, det högra synfältet och samtidigt i båda synfälten. Felstaplar för kontrolldeltagare anger standardfel.
Median RT för bilaterala målförsök subtraherades från medelvärdet av median RT för vänstra och högra unilaterala mål för att beräkna en RTE för varje kontrolldeltagare.
Gruppens genomsnittliga RTE var 33 ms (SEM = 6,65).
Patient ML:s median-RT var längre än kontrollerna (figur 7) och låg över den övre gränsen för 95 % KI för kontrollgruppens genomsnittliga RT för alla tre tillstånd (vänster = 322 ms; höger = 307 ms; båda = 277 ms). RTs för unilaterala mål i det högra (contralesionala) fältet var längre än för unilaterala mål i det vänstra (ipsilesionala) fältet (t = 4,9, p = 0,001). Det fanns ingen RTE. RTs för bilaterala mål (361 ms) var inte kortare än för unilaterala mål i det ipsilesionala (vänstra) synfältet (363 ms). Tabell 1 (nederst) visar att den RTE som beräknades för patient ML var signifikant mindre än RTE för hennes kontrollgrupp.
Diskussion
Enkla RT:er mättes för att upptäcka enstaka mål i antingen det kontralesionella eller det ipsilesionella fältet, och bilaterala mål, hos två patienter där SC:s brachium var skadat i den ena hemisfären. Hos en av patienterna (en ung kvinna) var skadan i den vänstra hemisfären och berodde på en traumatisk hjärnskada, och även om skadan omfattade inferior colliculus och sträckte sig in i mellanhjärnans tegmentum, var skadan på SC i sig inte uppenbar med högupplöst neuroimaging. Hos den andra patienten (en äldre kvinna) fanns skadan i den högra hemisfären och orsakades av en hypertensiv blödning som också orsakade omfattande skador på den mediala pulvinaren och den laterala thalamus och sträckte sig in i den dorsala mellanhjärnan, inklusive den rostrala SC. Hos båda patienterna var enkel RT för att upptäcka visuella mål i det contralesionala fältet långsammare jämfört med det ipsilesionala fältet. Ingen av patienterna uppvisade en spatial summationseffekt (RTE) för måldetektering när stimuli presenterades i båda synfälten.
Dessa observationer kastar ljus över SC:s roll vid måldetektering och, mer specifikt, rollen för visuella afferenter till SC. Posner et al. (1980) definierade operativt upptäckt som bevisat av förmågan att göra ett godtyckligt svar på en visuell signal (t.ex. en enkel tangenttryckning med ett finger, som i det aktuella experimentet). De antog att detektion kräver en allokering av uppmärksamhet för att välja mål för bearbetning i ett system med begränsad kapacitet som prioriterar det för att agera.
Song et al. (2011) visade att inaktivering av apornas SC orsakar påfallande målvalsunderskott som inte lätt kan förklaras som en enkel försämring av visuell perception eller motoriskt utförande, och föreslog att det bidrar till en mer allmänt användbar prioriteringskarta. I det experimentet presenterades aporna för två stimuli i motsatta synfält och var tvungna att med en sträcksvarighet ange vilket som dök upp först. En apa tränades att sträcka sig mot det stimulus som syntes först, och en apa tränades att sträcka sig mot det mål som syntes sist. I båda fallen fanns det en stark bias mot att välja det mål som fanns i det visuella fältet contralateralt till skadan. Eftersom samma bias sågs hos den apa som sträckte sig mot det andra målet som dök upp, kunde biasen inte bero på en fördröjning i uppfattningen av det contralesionala målet. Kollikulär inaktivering orsakade ingen försämring av den perceptuella bedömningen av vilket stimulus som dök upp först. Snarare var stimuli i synfältet contralateralt till den inaktiverade colliculus missgynnade när det gällde att prioriteras för handling.
Zhaoping (2016) har nyligen lyft fram en distinktion mellan neurala saliencykartor och prioriteringskartor, och argumenterat för en evolutionär migration av en perceptuell saliencykarta från optic tectum/SC till primär visuell cortex. Hon föreslog att salience-signaler kan överföras till en prioritetskarta i SC utan att projicera egenskapen feature tuning.
Sc:s brachium överför afferenta visuella signaler till de ytliga skikten av colliculus från näthinnan via retino-tectal tract; men majoriteten av de visuella afferenta fibrerna som överförs genom brachium är projektioner från primär visuell cortex. Om brachium störs kan signaler från den primära visuella cortexen vidarebefordras till colliculus via de främre ögonfälten. Men i avsaknad av direkta projektioner till de ytliga skikten av colliculus från näthinnan eller från den visuella cortexen, vilket vi antar är fallet hos patienter med brachiumskador, tar det längre tid för den colliculära prioriteringskartan att aktiveras, vilket resulterar i långsammare reaktioner på contralesionella visuella signaler.
Som nämndes i inledningen är bidraget till RTE som baseras på en probabilistisk kapplöpningsmodell beroende av att båda målen upptäcks; och av en kapplöpning där effektiviteten hos de oberoende kanalerna där de två målen överförs är likvärdiga, så att utfallet av kapplöpningen för att nå upptäcktströskeln är slumpmässigt från försök till försök. Eftersom detektionströskeln för contralesionala signaler är högre hos de patienter som rapporteras här, skulle redundanta mål inte kunna gynnas baserat på ett stokastiskt hästkapplöpning; det vill säga att utfallet av kapplöpningen mellan ipsilesionala och contralesionala signaler inte är slumpmässigt – contralesionala signaler har större sannolikhet att förlora kapplöpningen än att vinna den.
När det gäller hemianopiska patienter, har forskningen visat att det också finns en neuronal summationskomponent som bidrar till RTE och som inte är beroende av detektion av båda målen (Marzi et al, 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Eftersom commissurotomerade patienter har visat sig ha en RTE(Marzi et al., 1986; Reuter-Lorenz et al., 1995) har det hävdats att interhemisfärisk integration av signaler över den vertikala meridianen måste ske subkortikalt.
Savazzi och Marzi (2004) visade att neuronal summering inte inträffade med kromatiska målstimuli med kort våglängd vare sig hos neurologiskt intakta personer eller hos patienter med delad hjärna. Leh et al. (2006b) rapporterade att även om en RTE inträffade med achromatiska stimuli hos vissa hemianopiska hemisfärektomerade patienter, fanns det ingen RTE hos dessa patienter när kromatiska stimuli med kort våglängd användes som mål. Stimuli med kort våglängd (dvs. lila) aktiverar endast S-koner i näthinnan. Retinala ganglieceller som får input från S-koner projicerar inte vare sig direkt till SC eller till magnocellulära skikt i den laterala genikulära kärnan (De Monasterio, 1978). Eftersom projektioner från den primära visuella cortexen till SC genom SC:s brachium endast vidarebefordrar visuella visuella signaler från magnocellulära geniculostriate afferenter (Schiller m.fl, 1979), tyder det faktum att S-cone-stimuli inte ger upphov till en RTE på att neuronal summering sker i SC och är beroende av visuella afferenter som överförs genom dess brachium.
Det finns alltså samstämmiga bevis hos patienter med delad hjärna, hemianopiska patienter med blindhet och från experiment med kortvågiga stimuli, för att neuronal summering sker i SC. Även om kortvågiga stimuli inte aktiverar retinala ganglieceller som projicerar till SC via brachium, kan man dock inte dra slutsatsen att colliculus är helt blind för sådana stimuli. Registreringar av enskilda enheter i apans SC har visat att kortvågiga stimuli aktiverar reaktioner i de ytliga skikten av colliculus. Dessutom har traktografi visat att SC har förbindelse med den intakta hemisfären hos de hemisfärektomerade patienterna med RTE (dvs. blindhet), men inte hos de patienter som inte visade tecken på blindhet, att SC har förbindelse med den intakta hemisfären (Leh et al, 2006a).
Fyndet i den aktuella undersökningen ger således det första direkta beviset för att rumslig summering sker i SC som är beroende av överföring av visuella signaler genom dess brachium.
Etikutlåtande
Den här studien genomfördes i enlighet med riktlinjerna och med godkännande av protokollet från NHS Ethics Committee, Bangor, Storbritannien, och School of Psychology Ethics Committee vid Bangor University, Storbritannien. Muntligt och skriftligt informerat samtycke inhämtades från alla deltagare i enlighet med Helsingforsdeklarationen.
Författarnas bidrag
MvK: Koncipierade forskningen, utformade och programmerade experimentet, samlade in och analyserade patientdata och bidrog till att skriva manuskriptet. KK: Samlade in kontrolldata, granskade relevant litteratur, analyserade kontrolldata och bidrog till att skriva manuskriptet. RR: Rekryterade patienter och analyserade neuroimagingstudier inklusive virtuell dissektion med DTI-traktografi, förberedde patientfallshistorier och bidrog till att skriva manuskriptet.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Karaktärisering och spridning av osäkerhet i diffusionsviktad MR-avbildning. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F. och Woolrich, M. W. (2007). Probabilistisk diffusionstraktografi med flera fiberriktningar: vad kan vi vinna? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). Den övre colliculus är känslig för gestaltliknande stimuluskonfiguration hos hemisfärektompatienter. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Reaktionstid som ett mått på intersensorisk facilitering. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O. och Wurtz, R. (1983). Visuella och okulomotoriska funktioner i apans substantia nigra pars reticulata. III. Minneskontingenta visuella och saccadresponser. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H. och Ptito, A. (2006a). Omedveten syn: nya insikter i det neuronala korrelatet till blindseende med hjälp av diffusionstraktografi. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Funktionell kartläggning av den mänskliga hörselhjärnan: fMRI-undersökning av en patient med auditiv agnosi till följd av trauma på inferior colliculus. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.0000000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C. och Davidson, B. (1980). Uppmärksamhet och upptäckt av signaler. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Statistisk underlättande av enkla reaktionstider. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S. och Hughes, H. C. (1995). De försummade målens öde: en kronometrisk analys av redundanta måleffekter i den tvådelade hjärnan. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., and Marzi, C. A. (2004). Den övre colliculus understödjer interhemisfärisk neuronal summering hos både normala personer och patienter med total sektion eller agenesi av corpus callosum. Neuropsychologia 42, 1608-1618. doi: 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G. och Schein, S. J. (1979). Sammansättning av geniculostriate input ot superior colliculus of the rhesus monkey. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M. och Wurtz, R. (2000). Sammansättning och topografisk organisation av signaler som skickas från det frontala ögonfältet till superior colliculus. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar