Naturens flykt från genetiskt fängelse
Posttranslationsmodifiering: En kort översikt
Hur fungerar posttranslationsmodifiering?
De vanligaste posttranslationsmodifieringarna
Posttranslationsmodifieringens inverkan på hälsa och sjukdom
En kort översikt
Vad innebär PTM?
Celler måste upptäcka och reagera på förändringar i inre och yttre förhållanden. En metod som används för att anpassa sig till dessa förändringar är att kemiskt modifiera proteiner. Villkorliga kemiska förändringar förmedlas från sensorer till effektorer via reversibla posttranslationella modifieringar (PTM) av proteiner. PTMs spelar en viktig roll när det gäller att modifiera slutprodukten av uttrycket, bidrar till biologiska processer och sjukdomstillstånd och spelar en nyckelroll i många cellulära processer, t.ex. celldifferentiering (1), proteinnedbrytning, signal- och regleringsprocesser, reglering av genuttryck och protein-proteininteraktioner (2,3).
Hur fungerar posttranslationell modifiering?
PTMs kan ske i vilket steg som helst av proteinets livslängd. Många proteiner modifieras kort efter det att översättningen avslutats för att förmedla korrekt veckning eller för att styra det framväxande proteinet till distinkta cellplaceringar (t.ex. kärnan eller membranet). Andra modifieringar sker efter det att veckningen och lokaliseringen är avslutad för att aktivera eller inaktivera katalytisk aktivitet. Proteiner är också kovalent kopplade till taggar som riktar ett protein för nedbrytning. De modifieras genom en kombination av posttranslationell klyvning och tillägg av funktionella grupper genom en stegvis mekanism för proteinmognad eller aktivering.
Var sker posttranslationell modifiering? PTM:er sker vid distinkta aminosyrasidekedjor eller peptidlänkar och förmedlas oftast av enzymatisk aktivitet. Faktum är att 5 % av proteomet består av enzymer som utför mer än 200 typer av PTM:er (4). Dessa enzymer omfattar kinaser, fosfataser, transferaser och ligaser, som lägger till eller tar bort funktionella grupper, proteiner, lipider eller sockerarter till eller från aminosyrans sidokedjor, och proteaser, som klyver peptidbindningar för att ta bort specifika sekvenser eller regulatoriska underenheter. Många proteiner kan också modifiera sig själva med hjälp av autokatalytiska domäner, t.ex. autokinas- och autoprotolytiska domäner. PTM:er kan också vara reversibla beroende på modifieringens karaktär. Som exempel kan nämnas att fosfataser hydrolyserar fosfatgruppen för att avlägsna den från proteinet och vända dess biologiska aktivitet (figur 1).
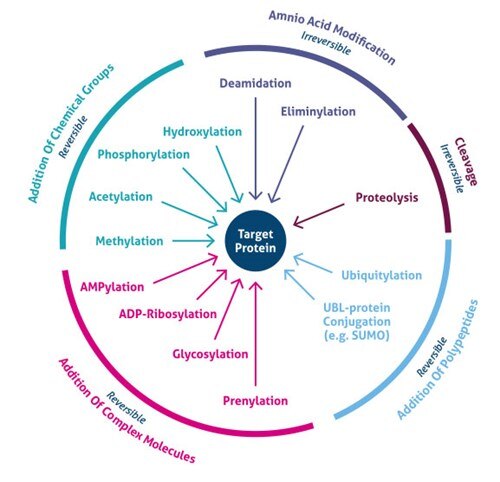
Figur 1. Typer av posttranslationella modifieringar (PTM).
De vanligaste posttranslationella modifieringarna
Den senaste utvecklingen av metoder för masspektrometri (MS) har gjort det möjligt att identifiera tusentals PTM-platser. Följaktligen har nya anrikningsstrategier avslöjat den globala cellulära betydelsen av flera typer av modifieringar (t.ex. acetylering, ubiquitylering, O-GlNac, N-länkad glykosylering). Mer än 200 olika typer av PTMs är för närvarande kända (5,6), som sträcker sig från små kemiska modifieringar (t.ex. fosforylering och acetylering) till tillägg av hela proteiner (t.ex. ubiquitylering, figur 3).
Fosforylering
Proteinfosforylering (figur 2) är den vanligaste studerade posttranslationella modifieringen. Det har uppskattats att en tredjedel av däggdjurens proteiner kan vara fosforylerade, och denna modifiering spelar ofta en nyckelroll när det gäller att modulera proteinets funktion. Fosforylering sker på serin-, threonin- och tyrosinrester och reglerar proteinfunktion, enzymatisk aktivitet, protein-proteininteraktioner och proteinlokalisering. Fosforylering katalyseras av fosfataser och kan vara reversibel – fosforylerade proteiner kan avfosforyleras av proteindefosfataser.
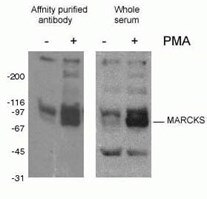
Figur 2. WB-resultat av phospho-Marcks antikropp (10018-3-AP, 1:1500) med mus J774 makrofagceller som behandlats med PMA.
Glykosylering och glykanering
Majoriteten av de proteiner som syntetiseras på ribosomer som är associerade med det endoplasmatiska retikulumet genomgår glykosylering. Det innebär att en kovalent fastsättning av sockerdelar läggs till polypeptidkedjan. De två vanligaste typerna av glykosylering hos eukaryoter är N-länkad glykosylering – till asparagin, och O-länkad glykosylering – till serin och threonin.
Ubiquitering
Protein ubiquitering innebär att ett kovalent ubiquitin läggs till lysin, cystein, serin, threonin eller direkt till proteinets N-terminus. Ubiquitin är ett litet (+/-8,6 kDa) protein som uttrycks i nästan alla vävnadstyper (figur 3). Ubiquitinering är en enzymatisk reaktion som katalyseras av en kaskad av tre enzymer (E1, E2 och E3). Det ger substratspecificitet och aktiverings-, konjugerings- och ligeringssteg. Proteiner kan vara monoubiquitinerade (med en ubiquitinmolekyl) eller polyubiquitinerade. Polyubiquitinering sker när ytterligare ubiquitinmolekyler läggs till den ursprungliga ubiquitinmolekylen. Ubiquitering via proteomet kan markera proteiner för nedbrytning. Den är också viktig för cellulär signalering, internalisering av membranproteiner , samt utveckling och reglering av transkription.

Figur 3. MDA-MB-453s-celler utsattes för SDS PAGE följt av western blot med 10201-2-AP (ubiquitin-antikropp) i en utspädning på 1:600.
PTMs inverkan på hälsa och sjukdom
Analysen av proteiner och deras PTMs är särskilt viktig för studiet av hjärtsjukdomar, cancer, neurodegenerativa sjukdomar och diabetes (7). De största utmaningarna när det gäller att studera posttranslationellt modifierade proteiner är utvecklingen av specifika detektions- och reningsmetoder. Lyckligtvis håller dessa tekniska hinder på att övervinnas med en mängd nya och förfinade proteomiktekniker.
- Kemisk biologi: påklädda proteiner.
- Koncept inom sumoylering: ett decennium framåt.
- Proteomisk analys inom neurovetenskapen.
- Rollerna för posttranslationella modifieringar i samband med nätverk för proteininteraktion
- Dechiffrering av ett globalt nätverk av funktionellt associerade posttranslationella modifieringar.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
