THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
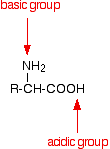
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Om man löser aminosyran i vatten innehåller en enkel lösning även denna jon.
En zwitterion är en förening som inte har någon övergripande elektrisk laddning, men som innehåller separata delar som är positivt och negativt laddade.
Tillförsel av alkali till en aminosyralösning
Om man höjer pH-värdet i en lösning av en aminosyra genom att tillsätta hydroxidjoner, avlägsnas vätejonen från -NH3+-gruppen.
![]()

Du skulle kunna visa att aminosyran nu existerar som en negativ jon med hjälp av elektrofores.
I sin enklaste form kan elektrofores bara bestå av ett stycke fuktat filterpapper på ett objektglas med ett krokodilspänne i vardera änden som är fäst vid ett batteri. En droppe aminosyrelösning placeras i mitten av pappret.
Och även om aminosyrelösningen är färglös kan man efter en tid hitta dess position genom att bespruta den med en ninhydrinlösning. Om pappret får torka och sedan värms upp försiktigt syns aminosyran som en färgad fläck.
Aminosyran skulle visa sig röra sig mot anoden (den positiva elektroden).
Har man tillsatt en syra till en aminosyrelösning
Om man sänker pH-värdet genom att tillsätta en syra till en lösning av en aminosyra, tar -COO-delen av zwitterionen upp en vätejon.
![]()
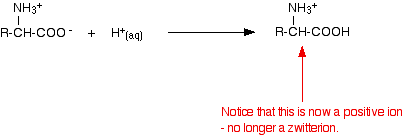
Den här gången, under elektroforesen, skulle aminosyran röra sig mot katoden (den negativa elektroden).
Förskjutning av pH från den ena ytterligheten till den andra
Antag att du börjar med jonen som vi just har framställt under sura förhållanden och långsamt tillsätter alkali till den.
Den jonen innehåller två sura väteämnen – det ena i -COOH-gruppen och det andra i -NH3+-gruppen.
Den mest sura av dessa är den i -COOH-gruppen, och därför avlägsnas den först – och du får tillbaka zwitterjonen.
![]()
![]()
När du har tillsatt precis rätt mängd alkali har aminosyran inte längre någon positiv eller negativ nettoladdning. Det innebär att den inte skulle röra sig mot vare sig katod eller anod under elektroforesen.
Det pH-värde vid vilket denna brist på rörelse under elektroforesen inträffar är känt som aminosyrans isoelektriska punkt. Detta pH varierar från aminosyra till aminosyra.
Om du fortsätter att tillsätta hydroxidjoner får du den reaktion vi redan har sett, där en vätejon avlägsnas från -NH3+-gruppen.
![]()
![]()