1) Introdução
A via de saída cardíaca (OFT) é uma estrutura transitória no pólo arterial do coração conectando os ventrículos embrionários com o saco aórtico. A OFT se forma durante o looping cardíaco a partir de células progenitoras cardíacas na mesoderme faríngea. Em sua extensão máxima o OFT é um cilindro miocárdico torsionado revestido de células endocárdicas, com domínios ortogonais mas contíguos proximais (conal) e distais (truncais). O OFT é posteriormente remodelado, concomitantemente com a septação ventricular, durante a qual a parede do OFT gira e se divide para gerar a base da aorta ascendente e do tronco pulmonar. A remodelação da OFT está associada à formação de um septo de saída, morfogênese valvar semilunar, arteriogênese coronariana e maturação dos componentes músculo miocárdico e liso da base das grandes artérias. A perturbação genética ou ambiental do alongamento e remodelação da OFT levam a defeitos cardíacos congênitos conotruncais, representando 30% de todas as cardiopatias congênitas (aproximadamente 0,3% dos nascidos vivos) (Bruneau, 2008; Srivastava e Olson, 2000). Extensos estudos anatômicos, experimentais e genéticos da morfogênese OFT têm revelado o envolvimento de múltiplos tipos celulares e vias de sinalização no desenvolvimento de OFT, sugerindo que a complexidade do desenvolvimento está subjacente à elevada incidência de anomalias OFT no homem.
2) Formação de OFT
Durante o alongamento do tubo cardíaco, o miocárdio é progressivamente adicionado ao pólo arterial do coração a partir de uma população de células progenitoras na mesoderme faríngea denominada segundo campo cardíaco (SHF; Figura 1A) (Buckingham et al, 2005; Kelly e Buckingham, 2002), (Cai et al., 2003). A SHF é posicionada na mesoderme medial mas contígua às células que dão origem ao primeiro tubo cardíaco; posteriormente, as células SHF estão subjacentes à endoderme ventral do antebraço, constituindo a parede dorsal da cavidade pericárdica. A SHF contribui para o ventrículo direito, além do pólo venoso e regiões AV do coração; essa população de células progenitoras que contribuem exclusivamente para o pólo arterial é conhecida como o campo cardíaco anterior ou secundário. Os reguladores transcripcionais críticos do desenvolvimento da SHF foram identificados e incluem os fatores de transcrição Isl1, Foxh1, Tbx1, Pitx2 e Mef2c (revisados em (Buckingham et al., 2005)). As principais propriedades da SHF incluem sua posição medial, atraso na diferenciação e proliferação elevada em relação às células que dão origem ao início do tubo cardíaco. Estas propriedades são reguladas tanto intrinsecamente como pelas células CNC circundantes e ectoderme faríngeo e endoderme através da actividade das moléculas de sinalização do factor de crescimento do fibroblasto, proteína morfogenética óssea, Hedgehog e vias Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Juntos, esses sinais definem o nicho que mantém as células progenitoras de SHF e regulam sua implantação progressiva durante a extensão OFT (Rochais et al., 2009). O OFT é revestido por células endocárdicas também pensadas para derivar da mesoderme faríngea (Laugwitz et al., 2008).
Durante o alongamento do tubo cardíaco, o miocárdio é progressivamente adicionado ao pólo arterial do coração a partir de uma população de células progenitoras na mesoderme faríngea denominada segundo campo cardíaco (SHF; Figura 1A) (Buckingham et al., 2005; Kelly e Buckingham, 2002), (Cai et al., 2003). A SHF é posicionada na mesoderme medial mas contígua às células que dão origem ao primeiro tubo cardíaco; posteriormente, as células SHF estão subjacentes à endoderme ventral do antebraço, constituindo a parede dorsal da cavidade pericárdica. A SHF contribui para o ventrículo direito, além do pólo venoso e regiões AV do coração; essa população de células progenitoras que contribuem exclusivamente para o pólo arterial é conhecida como o campo cardíaco anterior ou secundário. Os reguladores transcripcionais críticos do desenvolvimento da SHF foram identificados e incluem os fatores de transcrição Isl1, Foxh1, Tbx1, Pitx2 e Mef2c (revisados em (Buckingham et al., 2005)). As principais propriedades da SHF incluem sua posição medial, atraso na diferenciação e proliferação elevada em relação às células que dão origem ao início do tubo cardíaco. Estas propriedades são reguladas tanto intrinsecamente como pelas células CNC circundantes e ectoderme faríngeo e endoderme através da actividade das moléculas de sinalização do factor de crescimento do fibroblasto, proteína morfogenética óssea, Hedgehog e vias Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Juntos, esses sinais definem o nicho que mantém as células progenitoras de SHF e regulam sua implantação progressiva durante a extensão OFT (Rochais et al., 2009). O OFT é revestido por células endocárdicas também pensadas para derivar da mesoderme faríngea (Laugwitz et al., 2008).
Durante a formação do OFT o pólo arterial do coração é deslocado caudalmente na região faríngea como morfogênese do arco faríngeo e ocorre a formação de artérias do arco aórtico bilateral (Waldo et al., 2005b). Células CNC, derivadas do tubo neural dorsal, migram através dos arcos faríngeos faríngeos caudais para a OFT do coração durante a formação da região distal da OFT (Figura 1B) (Hutson e Kirby, 2003). Além de um papel crítico na remodelação da OFT, as células CNC desempenham um papel precoce na restrição da proliferação e no controle da implantação da SHF (Waldo et al., 2005a). Como células CNC entram na OFT distal, células endoteliais na região proximal da OFT passam por um processo de transição epitelial para mesenquimal em resposta a sinais derivados do miocárdio, para formar, juntamente com células invasoras da crista neural, almofadas OFT entre as camadas miocárdica e endotelial (Sugishita et al., 2004b). A convergência das almofadas OFT em uma estrutura espiral separa o fluxo laminar dos ventrículos esquerdo e direito embrionários. O desenvolvimento das almofadas depende de múltiplas vias de sinalização intercelular incluindo fator de crescimento transformador b, fator de crescimento fibroblasto, proteína morpogenética óssea, VEGF, Notch e sinalização não-canônica Wnt (Wagner e Siddiqui, 2007). O OFT atinge seu comprimento máximo na meia-gestão no mouse (E10.5) ou na 4ª semana de desenvolvimento em man.
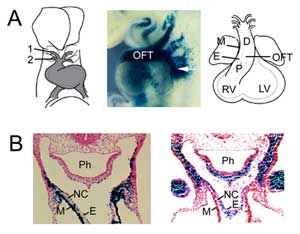
Figure 1
FormaçãoOFT. (A) O OFT no dia embrionário do rato 8.5 está ligado à primeira (1) e segunda (2) artérias do arco aórtico (esquerda) e estende-se por adição de células progenitoras do segundo campo cardíaco da mesoderme faríngea (meio, seta), visualizado com um transgene Fgf10 enhancer trap transgene em E9.5. O OFT atinge o comprimento máximo no dia embrionário do rato 10,5 e é composto por regiões proximais (P) e distais (D). (B) Comparação da expressão do transgene Fgf10 no OFT e segundo campo cardíaco (esquerda) com células derivadas da crista neural (direita) no OFT distal em E9.5. Painel da direita reproduzido de Jiang et al., 2001, Development 127:1607-16, com permissão. M, miocárdio; E, endocárdio; VD, ventrículo direito; VE, ventrículo esquerdo; Ph, faringe; NC, células derivadas de crista neural.
3) OFT remodelação
Durante a remodelação OFT o ventrículo esquerdo adquire uma saída independente, a aorta ascendente, fornecendo um conduto sistêmico crítico para o sangue oxigenado ao nascimento. A OFT cilíndrica é transformada na base da aorta ascendente e do tronco pulmonar (saída do ventrículo direito) concomitantemente com a septação atrioventricular e a remodelação da artéria do arco aórtico entre os dias 10,5 e 14,5 da gestação do rato. A remodelação da OFT é um processo complexo com contribuições tanto da genética como da hemodinâmica (Yashiro et al., 2007). Os papéis críticos do desenvolvimento da almofada OFT e das células CNC neste processo são estabelecidos (Sugishita et al., 2004b). O miocárdio proximal do OFT é incorporado à saída ventricular e um processo de miocardialização invasiva leva à musculalização do septo da saída proximal (Rana et al., 2007; van den Hoff et al., 2001). O crescimento do septo aorticopulmonar entre as artérias do 4º e 6º arco aórtico separa a OFT distal em aorta ascendente e tronco pulmonar (Figura 2A). Paredes musculares lisas desenvolvem-se na base das grandes artérias a partir da contribuição final do segundo campo cardíaco e mais distalmente dos CNCs (Sugishita et al., 2004b; Waldo et al., 2005b).
separação OFT é acompanhada pela rotação da parede OFT no sentido anti-horário, resultando no alinhamento da aorta com o ventrículo esquerdo e do tronco pulmonar com o ventrículo direito (Bajolle et al., 2006). Este processo de septação é completado pela convergência da OFT, septos atrioventricular e ventricular (Figura 2A). A parede miocárdica distal original da OFT contribui em parte para o miocárdio subpulmonar do ventrículo direito e em parte sofre morte celular programada por hipóxia durante o alinhamento ventriculoarterial (Rana et al., 2007; Sugishita et al., 2004a). Durante o processo de remodelação, as valvas semilunares se formam na junção angular das regiões proximal e distal do OFT a partir das almofadas OFT originais e duas intercaladas (Anderson et al., 2003). Arteriogênese coronariana é o processo pelo qual o plexo coronariano derivado de epicárdio invade seletivamente a base da aorta acima das duas cúspides valvares voltadas para o tronco pulmonar, formando óstios conectando o sistema coronariano com a aorta ascendente (Figura 2B) (Tomanek, 2005).
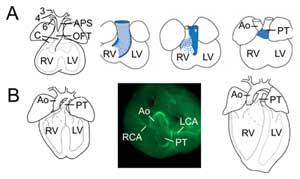
Figure 2.
Remodelação da via de saída. (A) No dia embrionário 11.5 o OFT está ligado à terceira (3), quarta (4) e sexta (6) artérias do arco aórtico (esquerda). O septo aorticopulmonar (APS) separa a OFT distal em aorta ascendente (Ao) e o tronco pulmonar (TP) convergindo com as almofadas OFT (C). As três imagens à direita mostram rotação progressiva da parede miocárdica durante a septação OFT: a parede dorsal no dia embrionário 10,5 (azul) dá origem ao miocárdio subpulmonar ventral. (B) No dia embrionário 14,5 (azul) a septação OFT está completa e a aorta está conectada ao ventrículo esquerdo e o tronco pulmonar ao ventrículo direito. Em uma visão superior (média) a imunoquímica da actina muscular lisa revela as conexões das artérias coronárias esquerda (LCA) e direita (RCA) com a base da aorta. Estrutura do coração definitivo (direita). VD, ventrículo direito; VE, ventrículo esquerdo.
4) Defeitos cardíacos congênitos conotruncais
A complexidade de desenvolvimento subjacente ao desenvolvimento da OFT se reflete na alta incidência de anomalias conotruncais no homem (Bruneau, 2008; Srivastava e Olson, 2000). Falhas de implantação de SHF ou CNC ou de remodelação de OFT contribuem para o espectro de defeitos conotruncais observados em patologia humana e modelos animais (Figura 3) (Lua, 2008).
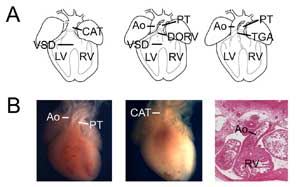
Figure 3.
Congenital heart defects. (A) Desenhos animados mostrando tronco arterial comum (ou truncus arteriosus persistant, CAT, esquerda), ventrículo direito de dupla saída (DORV, médio) e transposição das grandes artérias (TGA, direita). CIV, defeito septal ventricular; VD, ventrículo direito; VE, ventrículo esquerdo, Ao, aorta; TP, tronco pulmonar. (B) Exemplos de modelos de camundongos de cardiopatias congênitas. Coração controle mostrando a aorta e o tronco pulmonar (esquerda) comparado a um Tbx1 coração nulo (médio) com uma única saída ventricular (CAT). Exemplo de uma transposição tipo dupla saída ventricular direita mostrando a aorta conectada com o ventrículo direito em um Tbx3 coração nulo (direita). nde o grave comprometimento do desenvolvimento de SHF leva à falha no alongamento do tubo cardíaco, defeitos mais leves resultam em anomalias de alinhamento ventriculoarterial e falha da aorta em estabelecer uma conexão independente com o ventrículo esquerdo (Abu-Issa e Kirby, 2007). Estes defeitos podem ser intrínsecos à SHF ou afetar os tipos de células circundantes (CNC ou epitélio faríngeo) que controlam o nicho de células progenitoras da SHF. Tais defeitos podem resultar em dupla saída do ventrículo direito, aorta superior, hipoplasia pulmonar, atresia pulmonar e tetralogia de Fallot. A perda ou redução do CNC leva à falha ou atraso da septação da OFT resultando na persistência do truncus arteriosus ou dupla saída do ventrículo direito; a deficiência do CNC também afeta indiretamente o desenvolvimento da SHF resultando em um alinhamento composto e fenótipo de septação (Hutson e Kirby, 2003). A falha de rotação da parede OFT durante a remodelação da OFT também resulta em defeitos de alinhamento, incluindo transposição das grandes artérias, dupla saída do ventrículo direito e aorta superior, comumente subseqüentes a defeitos na lateralidade embrionária (Bajolle et al., 2006; Bamforth et al., 2001). Defeitos na formação do septo OFT também podem resultar de falhas posteriores na diferenciação da parede miocárdica e anomalias em processos essenciais para a remodelação, como morte celular programada ou miocardialização (Park et al., 2008). Defeitos intrínsecos nas células endocárdicas OFT, bem como alterações hemodinâmicas, também têm demonstrado levar a anomalias OFT 16, (Zhang et al., 2009), (Bartman e Hove, 2005; Yashiro et al., 2007). Finalmente, o padrão de anomalias coronarianas proximais está freqüentemente associado a defeitos conotruncais e, isoladamente, é uma causa significativa de morte cardíaca súbita (Angelini et al., 2002). Entre os objetivos da pesquisa atual estão uma melhor compreensão da etiologia das anomalias conotruncais através da identificação de mutações genéticas causadoras e modificadoras por meio de telas amplas do genoma e dissecção da contribuição relativa dos atores genéticos e epigenéticos na formação e remodelação de OFT utilizando modelos animais. Estes estudos fornecerão insights sobre as vias de sinalização e processos celulares que impulsionam a morfogênese dos OFT e são os alvos dos mecanismos da doença.