1) Introducción
El tracto de salida cardíaco (OFT) es una estructura transitoria en el polo arterial del corazón que conecta los ventrículos embrionarios con el saco aórtico. El OFT se forma durante el bucle cardíaco a partir de células progenitoras cardíacas en el mesodermo faríngeo. En su máxima extensión, el OFT es un cilindro miocárdico torsionado revestido de células endocárdicas, con dominios proximales (conales) y distales (troncales) ortogonales pero contiguos. El OFT se remodela posteriormente, de forma concomitante con la septación ventricular, durante cuyo proceso la pared del OFT gira y se divide para generar la base de la aorta ascendente y el tronco pulmonar. La remodelación del OFT está asociada a la formación de un tabique de salida, a la morfogénesis de la válvula semilunar, a la arteriogénesis coronaria y a la maduración de los componentes miocárdicos y del músculo liso de la base de las grandes arterias. Las perturbaciones genéticas o ambientales de la elongación y remodelación del OFT conducen a defectos cardíacos congénitos conotruncales, que representan el 30% de todos los defectos cardíacos congénitos (aproximadamente el 0,3% de los nacidos vivos) (Bruneau, 2008; Srivastava y Olson, 2000). Amplios estudios anatómicos, experimentales y genéticos de la morfogénesis del OFT han revelado la participación de múltiples tipos de células y vías de señalización en el desarrollo del OFT, lo que sugiere que la complejidad del desarrollo subyace a la elevada incidencia de anomalías del OFT en el hombre.
2) Formación del OFT
Durante la elongación del tubo cardíaco, el miocardio se añade progresivamente al polo arterial del corazón a partir de una población de células progenitoras en el mesodermo faríngeo denominada segundo campo cardíaco (SHF; Figura 1A) (Buckingham et al., 2005; Kelly y Buckingham, 2002), (Cai et al., 2003). El SHF se sitúa en el mesodermo medial pero contiguo a las células que dan lugar al tubo cardíaco temprano; posteriormente las células del SHF subyacen al endodermo ventral del intestino anterior, constituyendo la pared dorsal de la cavidad pericárdica. El SHF contribuye al ventrículo derecho además del polo venoso y las regiones AV del corazón; esa población de células progenitoras que contribuyen exclusivamente al polo arterial se conoce como campo cardíaco anterior o secundario. Se han identificado reguladores transcripcionales críticos del desarrollo del SHF e incluyen los factores de transcripción Isl1, Foxh1, Tbx1, Pitx2 y Mef2c (revisado en (Buckingham et al., 2005)). Las propiedades clave del SHF incluyen su posición medial, su retraso en la diferenciación y su elevada proliferación en relación con las células que dan lugar al tubo cardíaco temprano. Estas propiedades están reguladas tanto intrínsecamente como por las células CNC circundantes y el ectodermo y endodermo faríngeos a través de la actividad de las moléculas de señalización del factor de crecimiento de fibroblastos, la proteína morfogenética ósea, Hedgehog y las vías Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). En conjunto, estas señales definen el nicho que mantiene a las células progenitoras del SHF y regula su despliegue progresivo durante la extensión del OFT (Rochais et al., 2009). El OFT está revestido por células endocárdicas que también se cree que derivan del mesodermo faríngeo (Laugwitz et al., 2008).
Durante la elongación del tubo cardíaco, el miocardio se añade progresivamente al polo arterial del corazón a partir de una población de células progenitoras en el mesodermo faríngeo denominada segundo campo cardíaco (SHF; Figura 1A) (Buckingham et al., 2005; Kelly y Buckingham, 2002), (Cai et al., 2003). El SHF se sitúa en el mesodermo medial pero contiguo a las células que dan lugar al tubo cardíaco temprano; posteriormente las células del SHF subyacen al endodermo ventral del intestino anterior, constituyendo la pared dorsal de la cavidad pericárdica. El SHF contribuye al ventrículo derecho además del polo venoso y las regiones AV del corazón; esa población de células progenitoras que contribuyen exclusivamente al polo arterial se conoce como campo cardíaco anterior o secundario. Se han identificado reguladores transcripcionales críticos del desarrollo del SHF e incluyen los factores de transcripción Isl1, Foxh1, Tbx1, Pitx2 y Mef2c (revisado en (Buckingham et al., 2005)). Las propiedades clave del SHF incluyen su posición medial, su retraso en la diferenciación y su elevada proliferación en relación con las células que dan lugar al tubo cardíaco temprano. Estas propiedades están reguladas tanto intrínsecamente como por las células CNC circundantes y el ectodermo y endodermo faríngeos a través de la actividad de las moléculas de señalización del factor de crecimiento de fibroblastos, la proteína morfogenética ósea, Hedgehog y las vías Wnt (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). En conjunto, estas señales definen el nicho que mantiene a las células progenitoras del SHF y regula su despliegue progresivo durante la extensión del OFT (Rochais et al., 2009). El OFT está revestido por células endocárdicas que también se cree que derivan del mesodermo faríngeo (Laugwitz et al., 2008).
Durante la formación del OFT el polo arterial del corazón se desplaza caudalmente en la región faríngea a medida que tiene lugar la morfogénesis del arco faríngeo y la formación de las arterias bilaterales del arco aórtico (Waldo et al., 2005b). Las células CNC, derivadas del tubo neural dorsal, migran a través de los arcos faríngeos caudales hacia el OFT del corazón durante la formación de la región distal del OFT (Figura 1B) (Hutson y Kirby, 2003). Además de un papel crítico en la remodelación del OFT, las células CNC desempeñan un papel temprano en la restricción de la proliferación y el control del despliegue del SHF (Waldo et al., 2005a). Cuando las células del CNC entran en el OFT distal, las células endoteliales de la región proximal del OFT sufren un proceso de transición epitelial a mesenquimal en respuesta a las señales derivadas del miocardio, para formar, junto con las células de la cresta neural invasoras, cojines de OFT entre las capas miocárdica y endotelial (Sugishita et al., 2004b). La convergencia de los cojines OFT en una estructura en espiral separa el flujo laminar de los ventrículos izquierdo y derecho embrionarios. El desarrollo de los cojines depende de múltiples vías de señalización intercelular, como el factor de crecimiento transformante b, el factor de crecimiento de fibroblastos, la proteína morfogenética ósea, el VEGF, Notch y la señalización Wnt no canónica (Wagner y Siddiqui, 2007). El OFT alcanza su máxima longitud a mediados de la gestación en el ratón (E10.5) o en la 4ª semana de desarrollo en el hombre.
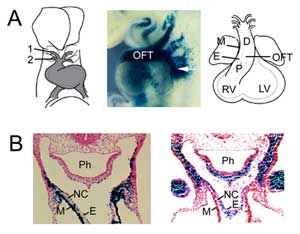
Figura 1
Formación del OFT. (A) El OFT en el día embrionario 8,5 de ratón está conectado a la primera (1) y segunda (2) arterias del arco aórtico (izquierda) y se extiende mediante la adición de células progenitoras del segundo campo cardíaco procedentes del mesodermo faríngeo (centro, flecha), visualizado con un transgen potenciador Fgf10 en E9,5. El OFT alcanza su máxima longitud en el día embrionario 10,5 del ratón y se compone de regiones proximales (P) y distales (D). (B) Comparación de la expresión del transgén Fgf10 en el OFT y el segundo campo cardíaco (izquierda) con las células derivadas de la cresta neural (derecha) en el OFT distal en E9.5. Panel derecho reproducido de Jiang et al., 2001, Development 127:1607-16, con permiso. M: miocardio; E: endocardio; RV: ventrículo derecho; LV: ventrículo izquierdo; Ph: faringe; NC: células derivadas de la cresta neural.
3) Remodelación del OFT
Durante la remodelación del OFT el ventrículo izquierdo adquiere una salida independiente, la aorta ascendente, proporcionando un conducto sistémico crítico para la sangre oxigenada en el nacimiento. El OFT cilíndrico se transforma en la base de la aorta ascendente y el tronco pulmonar (salida del ventrículo derecho) concomitantemente con la septación atrioventricular y la remodelación de la arteria del arco aórtico entre los días 10,5 y 14,5 de la gestación del ratón. La remodelación del OFT es un proceso complejo al que contribuyen tanto la genética como la hemodinámica (Yashiro et al., 2007). Se han establecido las funciones críticas del desarrollo del cojín del OFT y de las células del CNC en este proceso (Sugishita et al., 2004b). El miocardio de la OFT proximal se incorpora a la salida ventricular y un proceso de miocardialización invasiva conduce a la muscularización del tabique de salida proximal (Rana et al., 2007; van den Hoff et al., 2001). El crecimiento del tabique aórtico-pulmonar entre las arterias 4ª y 6ª del arco aórtico separa el OFT distal en la aorta ascendente y el tronco pulmonar (Figura 2A). Las paredes musculares lisas se desarrollan en la base de las grandes arterias a partir de la contribución final del segundo campo cardíaco y más distalmente a partir de las CNC (Sugishita et al., 2004b; Waldo et al., 2005b).
La septación del OFT se acompaña de la rotación de la pared del OFT en sentido contrario a las agujas del reloj, lo que resulta en la alineación de la aorta con el ventrículo izquierdo y del tronco pulmonar con el ventrículo derecho (Bajolle et al., 2006). Este proceso de septación se completa con la convergencia de los septos OFT, atrioventricular y ventricular (Figura 2A). La pared miocárdica distal original de la OFT contribuye en parte al miocardio subpulmonar del ventrículo derecho y en parte sufre una muerte celular programada impulsada por la hipoxia durante la alineación ventriculoarterial (Rana et al., 2007; Sugishita et al., 2004a). Durante el proceso de remodelación, se forman válvulas semilunares en la unión angular de las regiones proximal y distal del OFT a partir del cojín original y de dos cojines intercalados del OFT (Anderson et al., 2003). La arteriogénesis coronaria es el proceso por el cual el plexo coronario derivado del epicardio invade selectivamente la base de la aorta por encima de las dos valvas que dan al tronco pulmonar, formando ostia que conectan el sistema coronario con la aorta ascendente (Figura 2B) (Tomanek, 2005).
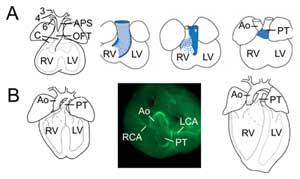
Figura 2.
Remodelación del tracto de salida. (A) En el día embrionario 11,5 el OFT está conectado a la tercera (3), cuarta (4) y sexta (6) arterias del arco aórtico (izquierda). El tabique aorticopulmonar (APS) separa el OFT distal en la aorta ascendente (Ao) y el tronco pulmonar (PT) que convergen con los cojines del OFT (C). Las tres imágenes de la derecha muestran la rotación progresiva de la pared miocárdica durante la septación del OFT: la pared dorsal en el día embrionario 10,5 (azul) da lugar al miocardio subpulmonar ventral. (B) En el día embrionario 14,5 la septación del TFO se ha completado y la aorta está conectada al ventrículo izquierdo y el tronco pulmonar al ventrículo derecho. En una vista superior (centro) la inmunoquímica de actina de músculo liso revela las conexiones de las arterias coronarias izquierda (LCA) y derecha (RCA) con la base de la aorta. Estructura del corazón definitivo (derecha). VD, ventrículo derecho; VI, ventrículo izquierdo.
4) Defectos cardíacos congénitos conotruncales
La complejidad subyacente del desarrollo del OFT se refleja en la alta incidencia de anomalías conotruncales en el hombre (Bruneau, 2008; Srivastava y Olson, 2000). Los fallos en el despliegue del SHF o del CNC o en la remodelación del OFT contribuyen al espectro de defectos conotruncales observados en la patología humana y en modelos animales (Figura 3) (Moon, 2008).
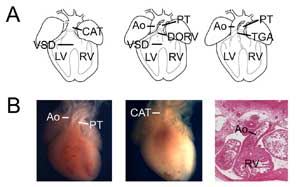
Figura 3.
Defectos cardíacos congénitos. (A) Dibujos animados que muestran el tronco arterial común (o tronco arterioso persistente, CAT, izquierda), el ventrículo derecho de doble salida (DORV, centro) y la transposición de las grandes arterias (TGA, derecha). CIV: comunicación interventricular; VD: ventrículo derecho; VI: ventrículo izquierdo; Ao: aorta; TP: tronco pulmonar. (B) Ejemplos de modelos de ratón de defectos cardíacos congénitos. Corazón de control que muestra la aorta y el tronco pulmonar (izquierda) comparado con un corazón nulo de Tbx1 (centro) con una única salida ventricular (CAT). Ejemplo de ventrículo derecho con doble salida de tipo transposición que muestra la aorta conectada con el ventrículo derecho en un corazón nulo de Tbx3 (derecha).
Mientras que una alteración grave del desarrollo del SHF conduce a un fallo en la elongación del tubo cardíaco, los defectos más leves dan lugar a anomalías en la alineación ventriculoarterial y al fracaso de la aorta para establecer una conexión independiente con el ventrículo izquierdo (Abu-Issa y Kirby, 2007). Estos defectos pueden ser intrínsecos al SHF o afectar a los tipos de células circundantes (CNC o epitelios faríngeos) que controlan el nicho de células progenitoras del SHF. Dichos defectos pueden dar lugar a un ventrículo derecho de doble salida, una aorta desviada, hipoplasia pulmonar, atresia pulmonar y tetralogía de Fallot. La pérdida o la reducción del CNC conduce al fracaso o al retraso de la septación del OFT, lo que da lugar a un tronco arterioso persistente o a un ventrículo derecho de doble salida; la deficiencia del CNC también afecta indirectamente al desarrollo del SHF, lo que da lugar a un fenotipo compuesto de alineación y septación (Hutson y Kirby, 2003). El fallo en la rotación de la pared del OFT durante la remodelación del OFT también da lugar a defectos de alineación que incluyen la transposición de las grandes arterias, la doble salida del ventrículo derecho y la anulación de la aorta, comúnmente subsiguientes a defectos en la lateralidad embrionaria (Bajolle et al., 2006; Bamforth et al., 2001). Los defectos en la formación del tabique del OFT también pueden ser consecuencia de un fallo posterior en la diferenciación de la pared miocárdica y de anomalías en procesos esenciales para la remodelación, como la muerte celular programada o la miocardialización (Park et al., 2008). También se ha demostrado que los defectos intrínsecos de las células endocárdicas del OFT, así como los cambios hemodinámicos, conducen a anomalías del OFT 16, (Zhang et al., 2009), (Bartman y Hove, 2005; Yashiro et al., 2007). Por último, el patrón anormal de las arterias coronarias proximales se asocia con frecuencia a los defectos conotruncales y, de forma aislada, es una causa importante de muerte cardíaca súbita (Angelini et al., 2002). Uno de los objetivos actuales de la investigación es comprender mejor la etiología de los defectos conotruncales mediante la identificación de las mutaciones genéticas causantes y de los modificadores a través de la selección del genoma y la disección de la contribución relativa de los actores genéticos y epigenéticos en la formación y remodelación del OFT utilizando modelos animales. Estos estudios proporcionarán información sobre las vías de señalización y los procesos celulares que impulsan la morfogénesis de los OFT y que son los objetivos de los mecanismos de la enfermedad.