Les produits agrochimiques contenant du ferrocène
La protection des cultures est une question importante en agriculture, rendue possible, en partie, par l’utilisation de produits chimiques pour lutter contre les parasites ou comme herbicides. D’autre part, l’inquiétude croissante concernant les effets néfastes des pesticides sur la santé et l’environnement, mise en évidence par l’introduction de nouvelles procédures d’enregistrement des pesticides (voir, par exemple, la loi sur la protection de la qualité des aliments aux États-Unis), a incité à rechercher de nouveaux pesticides, y compris des pesticides à base de produits naturels, pour remplacer les composés qui ne pouvaient plus être utilisés en raison des nouvelles exigences d’enregistrement. Des exemples peuvent être trouvés dans un certain nombre de revues . Dans la tentative d’obtenir des composés plus efficaces, le groupe ferrocényle a été introduit comme substituant dans les composés connus pour être actifs.
Des agents systémiques importants avec un large spectre d’activité fongicide contre les agents pathogènes des plantes sont des dérivés du 1H-1,2,4-triazole, tels que ceux présentés dans la figure 2.

Exemples de produits agrochimiques à base de 1H-1,2,4-triazole.
Il n’est donc pas surprenant que la plupart des produits agrochimiques à base de ferrocène (fongicides, herbicides) contiennent le même hétérocycle. De plus, assez souvent, ces mêmes composés ont révélé une activité prometteuse et quelque peu inattendue de régulation de la croissance des plantes. La synthèse est assez simple, à partir de l’acétylferrocène, 1, ou du ferrocène-carbaldéhyde, 2, et en utilisant des réactions organiques classiques, comme illustré dans les figures 3 et 4.

Strategies for the synthesis of 1H-1,2,4-triazole based ferrocenyl agrochemicals, starting from acetylferrocene.

Strategies for the synthesis of 1H-1,2,4-triazole based ferrocenyl agrochemicals, starting from ferrocenecarbaldehyde.
E and Z isomers of 3-aryl-1-ferrocenyl-2-triazolyl derivatives, 3, were tested for preventive fungicidal activity against powdery mildew on barley (foliar and soil drench applications) and for curative fungicidal activity against brown rust on wheat (foliar application). Selected results from foliar applications are reported in Table 1 (entry 1). Les isomères E ont montré une meilleure activité fongicide que les isomères Z, probablement en raison d’une caractéristique stérique favorable. De plus, une activité régulatrice de la croissance des plantes a été détectée, en pulvérisant les feuilles de pommiers de plantes cultivées à partir de graines. En faisant réagir les deux isomères avec la phénylhydrazine (Figure 3), on a obtenu des 5-aryl-3-ferrocényl-1-phényl-4-triazolyldihydropyrazoles, 4, qui ont été testés contre certaines souches bactériennes, avec des résultats peu satisfaisants.
Le cycle triazolyle a été éloigné du ferrocène en insérant un autre atome de carbone…, et les dérivés (E)-3-aryl-1-ferrocényl-2-triazolylméthyl résultants, 5, (Figure 3) ont été testés contre certains champignons (Pratylenchus zeae, Alternaria solani, Cladosporium fulvum, Physalospora piricola, et Cercospora arachidicola), avec des activités variables, généralement meilleures contre A. solani (tableau 1, entrée 2). Les dérivés issus de la réaction avec la phénylhydrazine, 6, ont cette fois présenté une meilleure performance (Tableau 1, entrée 3).
Les analogues ferrocényliques du triadiméfon, 7, ont été testés pour leurs activités antifongiques contre le mildiou et les rouilles sur des plantes de blé intravitales (Isariopsis clavispora, Bremia lactucae, C. fulvum, Erysiphe graminis, et Alternaria mali), mais, de façon décevante, tous les composés testés ont montré une activité antifongique plus faible (voir les exemples dans le tableau 1, entrée 4) contre tous les champignons que le triadimefon parent (92,8% et 96,6%, respectivement). Au contraire, l’activité régulatrice des plantes, testée par la méthode de rhizogenèse des cotylédons de concombre, a donné d’excellents résultats.
En réduisant les analogues du triadiméfon, les analogues ferrocényliques correspondants du triadiménol, 8, ont été obtenus . Ils ont été testés comme indiqué ci-dessus pour les analogues du triadiméfon et n’ont généralement pas présenté d’activité antifongique (tableau 1, entrée 5) ; cependant, ils ont tous montré une excellente capacité de régulation de la croissance des plantes, même plus grande que les précurseurs cétoniques.
Une légère variation structurelle a été le changement de OH à OMe, 9 . Cinq champignons (P. zeae, A. solani, C. fulvum, P. piricola et C. ara) ont été utilisés, avec des résultats modestes (voir, pour des exemples choisis, le tableau 1, entrée 6). Des résultats intéressants ont été obtenus à partir de l’activité de régulation de la croissance des plantes, déterminée par les méthodes d’élongation des germes de blé et d’enracinement des cotylédons de concombre.
Une approche différente pour synthétiser des dérivés du ferrocène contenant du triazole a été de partir du ferrocène-carbaldéhyde et des α-bromo arylcétones qui ont permis des variations structurelles (Figure 4).
Les trois familles de composés (avec des fonctionnalités CO, 11, OH, 12, et OMe, 13, respectivement) ont été testées pour les activités biologiques. Une faible activité régulatrice de la croissance des plantes (tests sur le coléoptile de blé et le cotylédon de concombre) a été observée, un peu moins avec les cétones. Une certaine activité antifongique in vitro a été enregistrée (contre Gibberella zeae, A. solani, Cercospora arachidicola, P. piricola, Phomopsis asparagi, Cladosporium cucumerinum, Sclerotinia sclerotiorum, et Pyricularia oryzae), mais elle n’était pas significative, selon les auteurs, si on la compare avec des agents commerciaux connus. Quelques données sélectionnées sont présentées dans le tableau 1 (entrées 8 à 10).
Des dérivés du ferrocényle avec différentes fonctionnalités ont également été étudiés. Il convient de noter que l’une des premières tentatives pour avoir des ferrocènes biologiquement actifs a introduit des aroylhydrazines comme substituants (Figure 5 ) : plus d’une décennie plus tard, il a été reconnu l’importance des composés naturels contenant de l’hydrazine, également en ce qui concerne les activités biologiques .

Synthesis of N-tert-butyl-N,N’-diacylhydrazines .
N-tert-butyl-N,N′-diacylhydrazines, mimicking the action of 20-hydroxyecdysone to activate the ecdysone receptor, lead to lethal premature molting, thus constituting a class of insect growth regulators useful in crop protection. The larvicidal activities were tested against Southern armyworm by foliar application. Results (Figure 6) indicate a good larvicidal activity, in comparison with the reference RH5849 (N-tert-butyl-N,N′-dibenzoylhydrazine) only when the tert-butyl group was far from ferrocenyl moiety.

Larvicidal activities (%) of N-tert-butyl-N,N’-diacylhydrazines with ferrocenoyl as one of the acyl groups .
1,1′-Disubstitued ferrocenes with different keto-ester, hydroxy-ester, and dihydroxy functionalities on both cyclopentadienyl rings were prepared (Figure 7 ) and assayed in vitro for antifungal activity against G. zeae, A. solani, C. arachidicola, P. piricola, and Fusarium oxysporum. The compounds showed relatively low fungicidal activity.

Example of synthesis of aroyl 1,1′-disubstituted ferrocenes .
Instead, ferrocenyl ethers , much easier to prepare (Figure 8) than previous diferrocenyl derivatives, showed moderate activity against two plant fungi, Botrytis cinerea and Penicillium species (Table 2).

Synthesis of ferrocenyl ethers 17-19.
Among herbicides, it is important to mention a series of cyanoacrylates containing ferrocene (Figure 9 ), that exhibited, according to the authors, excellent herbicidal activities against rape weeds.

Synthesis of ferrocenyl cyanoacrylates .
More recently, a series of ferrocenes substituted with pyrimidines (17 to 20, Figure 10) were prepared , because of their potentialities as herbicides and plant growth regulators, but the biological activities have not been tested yet. Il en est de même pour le trifluorométhylsulfanylferrocène, 21, le (trifluorométhylsulfanyl)éthynylferrocène, 22, et le (N-ferrocénylméthyl)benzènecarbamide, 23, représentés sur la figure 10.

Structures de dérivés du ferrocényle contenant de la pyrimidine ou du SCF3, avec une possible activité biologique.
Les ferrocènes comme catalyseurs dans la synthèse de produits agrochimiques
L’importance des produits agrochimiques est évidente, même si les conséquences environnementales de leur utilisation ne doivent pas être sous-estimées. Il est donc important de limiter la quantité de produits chimiques introduits dans l’environnement. En outre, il est devenu de plus en plus évident que les propriétés biologiques des produits agrochimiques chiraux sont liées à la configuration absolue. L’énantiomère non actif est inutile, voire nocif, de sorte que la synthèse énantiosélective est devenue indispensable. Le problème est bien illustré par le cas du (S)-métolachlore (Figure 11, IUPAC : (S)-N-(2-éthyl-6-méthyl)phényl-N-(1-méthyl-2-méthoxy)éthyl-2-chloroéthanammide), le plus important herbicide de la division Protection des cultures de Novartis (>20 000 tonnes/an).

Ligands ferrocényliques chiraux comme catalyseurs dans la synthèse énantiosélective de l’herbicide (S)-métolachlore.
Il est produit depuis 1978, d’abord sous forme de mélange racémique, puis (à partir de 1997) sous forme enrichie en énantiomères, ce qui a permis de réduire de 40% la charge environnementale. L’une des stratégies les plus importantes de la synthèse asymétrique est l’utilisation de catalyseurs chiraux. Le tournant de la synthèse asymétrique du métolachlore a été l’utilisation d’un catalyseur à l’iridium, rendu chiral par un ligand ferrocénylposphane chiral, le Josiphos. Le catalyseur était suffisamment robuste pour assurer un nombre de rotation (TON) et une fréquence de rotation (TOF) très élevés.
Pour le lecteur non familier avec les ferrocènes, il suffit de dire que deux substituants différents dans le même cycle cyclopentadiényle donnent lieu à deux énantiomères, qui présentent une chiralité planaire (Figure 12). Chaque énantiomère est indiqué comme R p ou S p (où p signifie planaire), selon les règles de Schlögl : l’observateur regarde le long de l’axe C 5 du ferrocène du côté du cycle Cp le plus fortement substitué, et la configuration absolue est donnée en fonction de l’arc le plus court à descendre en priorité, soit dans le sens des aiguilles d’une montre, soit dans le sens inverse.

Origin of planar chirality in ferrocenes (top) (Réimprimé avec la permission de Organometallics 32:5668-5704. Copyright (2013) American Chemical Society) et règle de Schlögl pour l’identification des énantiomères (bas).
Le succès du Josiphos et de sa modification Xyliphos a stimulé à la fois les applications industrielles des catalyseurs chiraux et la synthèse de nouveaux ferrocènes chiraux ainsi que leur utilisation en synthèse asymétrique . Ainsi, le premier Josiphos a été le composé parent d’une famille de ligands chiraux efficaces qui ont trouvé une application dans la synthèse énantiosélective d’autres composés utiles en agriculture. Pour ne donner qu’un exemple, l’allylation asymétrique de α-fluorocétones tertiaires, molécules utiles pour des applications vers des médicaments, des produits agrochimiques et des matériaux fonctionnels, a été réalisée, entre autres, avec des catalyseurs chiraux de type ferrocényle (Figure 13, ). Malheureusement, les e.e.s sont trop faibles pour être utiles.

Allylation énantiosélective de α-fluorocétones pour l’agrochimie, avec des catalyseurs ferrocényles chiraux .
Les ferrocènes dans la remédiation des sols
Les argiles natives sont apparues comme un composant actif des sols qui influencent la sorption des cations, des anions et des produits chimiques organiques hydrophobes. Par conséquent, leur importance dans l’élimination et la rétention des polluants augmente , également parce que les ions de fer dans le réseau argileux participent à des réactions d’oxydoréduction, qui peuvent être utiles contre la pollution par les ions métalliques ; par exemple, les chercheurs du site de Hanford dans l’État de Washington ont pu diminuer la quantité de Cr(VI) dans l’approvisionnement en eau de 1 ppm à un niveau inférieur aux limites de détection (7 à 8 ppb) en le réduisant en Cr(III), moins toxique et moins soluble, en tirant parti du fer structurel de l’argile, précédemment réduit en Fe(II) .
Pour l’assainissement des sols contaminés, l’application de tensioactifs gagne en importance . Les tensioactifs à base de ferrocène ont l’avantage d’agir à la fois comme tensioactifs et comme composés redox-actifs. Par conséquent, une série de tensioactifs ferrocényles de différentes longueurs de chaîne a été utilisée comme intercalants, afin de déterminer les conditions dans lesquelles le transfert électronique a lieu dans le Fe structurel de l’argile. Cette étude a permis d’acquérir une meilleure connaissance générale de l’activité du Fe dans les silicates naturels. Les tensioactifs ferrocényles (25 et 26 dans la Figure 14a) utilisés comme intercalants, ayant différentes longueurs de chaîne, ont assuré à la fois une gamme de potentiels et une gamme de conformations possibles ; comme argile, la montmorillonite standard du Wyoming (SWy-1), de formule (Al2.88Fe0,68Mg0,47)(Si7,7Al0,29)O20(OH)4, a été utilisée.

Sels de ferrocénylammonium utilisés dans les études relatives à la remédiation des sols (a) réf. 52 , (b) réf. 53.
The results indicated that ferrocenyl trimethylammonium derivatives with C6 (25) and C11 (26) chains can be oxidized by structural Fe(III) in clay, whereas ferrocenylmethyl trimethylammonium (24) is not oxidized (Figure 15).

Energy scheme for redox reactions of ferrocenyl surfactants with structural Fe(III) in clay .
Later, other ferrocenyl surfactants (27 and 28 in Figure 14b) were used to verify the possibility to exploit them as reversible surfactants . In fact, although the surfactant washing of contaminated soils and groundwater may be an effective approach, operating costs result high and the surfactants need to be recycled, in order to optimize surfactant-enhanced remediation (SER). As discussed in ref. , the methods developed are not satisfactory. Cette étude a montré que la solubilisation du benzène, du toluène et de l’éthylbenzène avec des tensioactifs ferrocényles était meilleure que celle des tensioactifs cationiques (bromure d’hexadécyltriméthylammonium (CTABr)) ou anioniques (dodécylsulfate de sodium (SDS)) couramment utilisés. En outre, l’efficacité d’élimination était plus élevée à de faibles concentrations de tensioactifs ferrocényles et, enfin, l’oxydation en cation ferrocénium permettait la séparation des composés organiques et, par conséquent, le recyclage du tensioactif.
Il convient de mentionner que les ferrocènes se sont avérés utiles pour mettre en évidence les propriétés redox du Fe(II) adsorbé sur les surfaces minérales . La mesure des potentiels de repos significatifs dans les systèmes environnementaux et géochimiques a été très difficile dans le passé, en raison, entre autres, de la lenteur du transfert d’électrons entre l’électrode de détection solide (typiquement Pt) et l’espèce redox active. Au lieu de cela, l’approche de transfert d’électrons médiée par le ferrocène a généré des sondes mobiles en solution qui peuvent réagir avec les espèces redox actives suffisamment rapidement pour fournir un courant mesurable, fournissant ainsi une mesure directe de la réactivité redox (c’est-à-dire les taux de transfert d’électrons) des espèces redox actives adsorbées.
Les ferrocènes comme capteurs
Les dérivés du ferrocène peuvent fonctionner à la fois comme des capteurs optiques et électrochimiques. Lorsqu’ils sont opportunément substitués, ils peuvent coordonner des anions ou des cations, avec un décalage de potentiel ou un changement de couleur conséquent . Seuls certains exemples récents seront rapportés ici.
- a)
Composés neutres. L’hydrazine et ses dérivés sont utilisés en agriculture comme pesticides mais entrent dans l’environnement également par les émissions industrielles. En raison de leur danger toxicologique, des méthodes d’analyse sensibles, fiables et rapides sont nécessaires. Un certain nombre de techniques instrumentales sont disponibles, mais les techniques électroanalytiques pourraient fournir des procédures portables, bon marché et rapides, malgré la lenteur cinétique de l’oxydation de l’hydrazine. En exploitant les nanotubes de carbone, la détermination électrocatalytique de la phénylhydrazine et de l’hydrazine a été réalisée à l’époque, avec une électrode en pâte de nanotubes de carbone modifiée par du ferrocène. Une telle électrode s’est avérée stable, facile à préparer et à renouveler en surface. Elle a présenté une sélectivité améliorée et a permis la détection de l’hydrazine et de la phénylhydrazine dans le même échantillon, de manière contemporaine.
- b)
Anions. L’importance de l’aspartate est indéniable : comme de nombreux anions chiraux, il entre dans les processus biologiques et chimiques, sans parler de l’aspartame, important sur le plan industriel. D’autre part, la reconnaissance énantiosélective par des molécules hôtes artificielles présente un intérêt croissant. Un certain nombre de ferrocènes 1,1′-disubstitués, avec un atome de carbone chiral et une partie thiourée dans les substituants, ont été préparés, et leur reconnaissance énantiosélective a été testée. Au moins deux d’entre eux présentent une bonne reconnaissance chirale, comme le montre le titrage optique avec du L- ou du D-N-acétylaspartate dans une solution de diméthylsulfoxyde (DMSO). Les changements de couleur sont significatifs, comme illustré dans la Figure 16, rendant ainsi ces ferrocènes des capteurs colorimétriques » à l’œil nu « .
Figure 16 
Capteur colorimétrique à base de ferrocènes pour le N-acétylaspartate. De gauche à droite : dérivé ferrocényle au-dessus, le même + L-N-acétylaspartate, le même + D-N-acétylaspartate ; dérivé ferrocényle en dessous, le même + L-N-acétylaspartate, le même + D-N-acétylaspartate. Adapté de Ref. , Eur J Org Chem 841-849. Réimprimé avec la permission. Copyright (2009) Wiley.
- c)
Cations. La détection des cations de métaux lourds dans l’environnement est d’une grande importance, en raison de leur diffusion à partir de sources industrielles et de leur traitement pour la santé. En particulier, le saturnisme est encore l’une des maladies les plus courantes causées par l’environnement et la détection des ions Pb(II) est absolument nécessaire, surtout dans l’eau potable . Après avoir réussi à reconnaître les anions liés aux phosphates par une ferrocénylimidazophénanthroline, qui a fonctionné à la fois comme capteur colorimétrique et électrochimique , les mêmes auteurs ont préparé des ferrocènes substitués par de l’imidazopyridine (ImPy) ou de l’imidazophénazine (ImPhen) (Figure 17), qui ont agi comme des récepteurs sélectifs envers les cations Pb(II) .
Figure 17 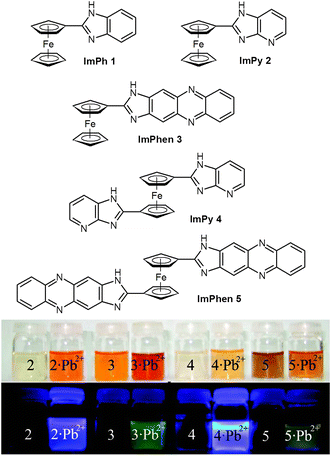
Sondes multicanaux sélectives pour les cations Pb(II) ; changements de couleur associés à la complexation des cations (en haut, absorption, en bas, émission). Adapté de Ref. J Org Chem 74:4787-4796, réimprimé avec permission. Copyright (2009) American Chemical Society.
The compounds, reported in Figure 17, show highly selective affinity for Pb(II) ions over a range of other metal ions, through different channels, i.e., as redox, chromogenic, and fluorescent chemosensors. For example, compound ImP2 showed, upon complexation with Pb(II) cation, an oxidation redox peak anodically shifted (ΔE 1/2 = 150 mV), a red-shifted absorption maximum (Δλ = 44 nm) and an emission with an important chelation-enhanced fluorescence effect.

Ferrocenyl thiourea as electrochemical chemodosimeter for Hg(II) cation .
D’autres chémodosenseurs à base de ferrocène, l’un sélectif pour le cation Hg(II) et l’autre sélectif pour le cation Cu(II), ont été développés en introduisant la 1,4-benzènediamine 31, la 4,4′-biphényldiamine 32, ou le 4,4′-diaminobenzènedisulfure, 33 . Ces composés ont donné lieu à des chimiosenseurs colorométriques très sensibles pour Cu(II) et Hg(II), avec des modifications permettant une détection » à l’œil nu « , comme on peut le voir sur la figure 19.
.

