Agrochemikalia zawierające ferrocen
Ochrona upraw jest ważnym zagadnieniem w rolnictwie, możliwym częściowo dzięki wykorzystaniu chemikaliów do zwalczania szkodników lub jako herbicydów. Z drugiej strony, rosnące zaniepokojenie niekorzystnym wpływem pestycydów na zdrowie i środowisko, czego dowodem jest wprowadzenie nowych procedur rejestracji pestycydów (patrz np. Food Quality Protection Act w Stanach Zjednoczonych), skłoniło do poszukiwania nowych pestycydów, w tym pestycydów opartych na produktach naturalnych, w celu zastąpienia związków, które nie mogły być dłużej stosowane ze względu na nowe wymagania rejestracyjne. Przykłady można znaleźć w wielu przeglądach . W dążeniu do uzyskania bardziej efektywnych związków wprowadzono grupę ferrocenylową jako podstawnik w związkach o znanej aktywności.
Ważnymi środkami systemicznymi o szerokim spektrum działania grzybobójczego wobec patogenów roślinnych są pochodne 1H-1,2,4-triazolu, takie jak przedstawione na rysunku 2.

Przykłady agrochemikaliów opartych na 1H-1,2,4-triazolu.
Nie dziwi zatem fakt, że większość agrochemikaliów opartych na ferrocenach (fungicydy, herbicydy) zawiera ten sam heterocykl. Co więcej, dość często te same związki wykazują obiecującą i dość nieoczekiwaną aktywność regulującą wzrost roślin. Synteza jest dość prosta, rozpoczyna się od acetyloferrocenu, 1, lub karbaldehydu ferrocenowego, 2, i wykorzystuje klasyczne reakcje organiczne, jak pokazano na Rysunkach 3 i 4.

Strategies for the synthesis of 1H-1,2,4-triazole based ferrocenyl agrochemicals, starting from acetylferrocene.

Strategies for the synthesis of 1H-1,2,4-triazole based ferrocenyl agrochemicals, starting from ferrocenecarbaldehyde.
E and Z isomers of 3-aryl-1-ferrocenyl-2-triazolyl derivatives, 3, were tested for preventive fungicidal activity against powdery mildew on barley (foliar and soil drench applications) and for curative fungicidal activity against brown rust on wheat (foliar application). Selected results from foliar applications are reported in Table 1 (entry 1). Izomery E wykazywały lepszą aktywność grzybobójczą niż izomery Z, co prawdopodobnie wynikało z korzystnej cechy sterycznej. Ponadto stwierdzono aktywność regulującą wzrost roślin, opryskując liście jabłoni roślin wyhodowanych z nasion. Reagując oba izomery z fenylohydrazyną (Rysunek 3), otrzymano 5-arylo-3-ferrocenylo-1-fenylo-4-triazolyldihydropirazole, 4, które testowano przeciwko niektórym szczepom bakteryjnym, uzyskując niezbyt zadowalające wyniki.
Pierścień triazolowy oddalono od ferrocenu wstawiając kolejny atom węgla , i otrzymane pochodne (E)-3-arylo-1-ferrocenylo-2-triazolylometylu, 5, (rysunek 3) testowano przeciwko niektórym grzybom (Pratylenchus zeae, Alternaria solani, Cladosporium fulvum, Physalospora piricola i Cercospora arachidicola), ze zmienną aktywnością, ogólnie lepszą przeciwko A. solani (tabela 1, pozycja 2). Pochodne reakcji z fenylohydrazyną, 6, tym razem wykazywały lepszą aktywność (Tabela 1, pozycja 3).
Ferrocenylowe analogi triadimefonu, 7, badano pod kątem aktywności przeciwgrzybiczej wobec mączniaków i rdzy na roślinach pszenicy w stanie wolnym (Isariopsis clavispora, Bremia lactucae, C. fulvum, Erysiphe graminis i Alternaria mali), ale, co rozczarowujące, wszystkie badane związki wykazały niższą aktywność przeciwgrzybiczą (patrz przykłady w tabeli 1, pozycja 4) wobec wszystkich grzybów niż macierzysty triadimefon (odpowiednio 92,8% i 96,6%). Natomiast aktywność regulacyjna wobec roślin, oceniana metodą rizogenezy liścieni ogórka, była doskonała.
Redukując analogi triadimefonu, otrzymano odpowiadające im analogi ferrocenylowe triadimenolu, 8. Były one badane jak wskazano powyżej dla analogów triadimefonu i generalnie nie wykazywały żadnej aktywności przeciwgrzybiczej (Tabela 1, pozycja 5); jednakże wszystkie wykazywały doskonałą zdolność regulacji wzrostu roślin, nawet większą niż keto prekursory.
Niewielką zmianą strukturalną była zmiana OH na OMe, 9. Zastosowano pięć grzybów (P. zeae, A. solani, C. fulvum, P. piricola i C. ara), uzyskując skromne wyniki (patrz, dla wybranych przykładów, tabela 1, pozycja 6). Interesujące wyniki uzyskano w przypadku aktywności regulującej wzrost roślin, określanej metodami wydłużania gemmy pszenicy i ukorzeniania liścieni ogórka.
Odmienne podejście do syntezy pochodnych ferrocenu zawierających triazole polegało na rozpoczęciu od ferrocenokarbaldehydu i α-bromo aryketonów, co pozwoliło na uzyskanie wariantów strukturalnych (rys. 4).
Trzy rodziny związków (odpowiednio z funkcjonałami CO, 11, OH, 12, i OMe, 13) testowano pod kątem aktywności biologicznej. Stwierdzono niewielką aktywność regulującą wzrost roślin (testy na koleoptylu pszenicy i liścieniu ogórka), nieco mniejszą w przypadku ketonów. Zarejestrowano pewną aktywność przeciwgrzybiczą in vitro (wobec Gibberella zeae, A. solani, Cercospora arachidicola, P. piricola, Phomopsis asparagi, Cladosporium cucumerinum, Sclerotinia sclerotiorum i Pyricularia oryzae), ale nie była ona znacząca, zdaniem autorów, w porównaniu ze znanymi środkami komercyjnymi. Kilka wybranych danych przedstawiono w tabeli 1 (pozycje 8-10).
Przebadano również pochodne ferrocenylowe o różnych funkcjach. Warto zauważyć, że jedna z pierwszych prób uzyskania biologicznie aktywnych ferrocenów wprowadziła aroilohydrazyny jako podstawniki (Rysunek 5): ponad dekadę później uznano znaczenie naturalnych związków zawierających hydrazyny, również w odniesieniu do aktywności biologicznej.

Synthesis of N-tert-butyl-N,N’-diacylhydrazines .
N-tert-butyl-N,N′-diacylhydrazines, mimicking the action of 20-hydroxyecdysone to activate the ecdysone receptor, lead to lethal premature molting, thus constituting a class of insect growth regulators useful in crop protection. The larvicidal activities were tested against Southern armyworm by foliar application. Results (Figure 6) indicate a good larvicidal activity, in comparison with the reference RH5849 (N-tert-butyl-N,N′-dibenzoylhydrazine) only when the tert-butyl group was far from ferrocenyl moiety.

Larvicidal activities (%) of N-tert-butyl-N,N’-diacylhydrazines with ferrocenoyl as one of the acyl groups .
1,1′-Disubstitued ferrocenes with different keto-ester, hydroxy-ester, and dihydroxy functionalities on both cyclopentadienyl rings were prepared (Figure 7 ) and assayed in vitro for antifungal activity against G. zeae, A. solani, C. arachidicola, P. piricola, and Fusarium oxysporum. The compounds showed relatively low fungicidal activity.

Example of synthesis of aroyl 1,1′-disubstituted ferrocenes .
Instead, ferrocenyl ethers , much easier to prepare (Figure 8) than previous diferrocenyl derivatives, showed moderate activity against two plant fungi, Botrytis cinerea and Penicillium species (Table 2).

Synthesis of ferrocenyl ethers 17-19.
Among herbicides, it is important to mention a series of cyanoacrylates containing ferrocene (Figure 9 ), that exhibited, according to the authors, excellent herbicidal activities against rape weeds.

Synthesis of ferrocenyl cyanoacrylates .
More recently, a series of ferrocenes substituted with pyrimidines (17 to 20, Figure 10) were prepared , because of their potentialities as herbicides and plant growth regulators, but the biological activities have not been tested yet. To samo dotyczy trifluorometylosulfanyloferrocenu, 21, (trifluorometylosulfanylo)etylenilferrocenu, 22 i (N-ferrocenylometylo)benzenokarbamidu, 23, przedstawionych na Rysunku 10.

Struktury pochodnych ferrocenylowych zawierających pirymidynę lub SCF3 , o możliwej aktywności biologicznej.
Ferroceny jako katalizatory w syntezie agrochemikaliów
Ważność agrochemikaliów jest oczywista, aczkolwiek nie można nie doceniać konsekwencji środowiskowych ich stosowania. Dlatego ważne jest, aby ograniczać ilość substancji chemicznych wprowadzanych do środowiska. Ponadto, coraz częściej okazuje się, że właściwości biologiczne chiralnych agrochemikaliów są związane z konfiguracją absolutną. Enancjomer nieaktywny jest niepotrzebny, a nawet szkodliwy, tak więc enancjoselektywna synteza stała się koniecznością. Problem ten dobrze ilustruje przypadek (S)-metolachloru (Rysunek 11, IUPAC: (S)-N-(2-etylo-6-metylo)fenylo-N-(1-metylo-2-metoksy)etylo-2-chloroetanamid), najważniejszego herbicydu Novartis Crop Protection Division (>20 000 ton/rok).

Chiralne ligandy ferrocenylowe jako katalizatory w enancjoselektywnej syntezie herbicydu (S)-metolachloru.
Jest on produkowany od 1978 r., najpierw jako mieszanina racemiczna, a następnie (od 1997 r.) w postaci wzbogaconej enancjomerycznie, co pozwoliło na zmniejszenie obciążenia środowiska o 40%. Jedną z najważniejszych strategii syntezy asymetrycznej jest zastosowanie katalizatorów chiralnych. Punktem zwrotnym w asymetrycznej syntezie metolachloru było zastosowanie katalizatora irydowego, uczynionego chiralnym przez chiralny ligand ferrocenyloporfanowy Josiphos. Katalizator był wystarczająco wytrzymały, aby zapewnić bardzo wysoką liczbę obrotów (TON) i częstotliwość obrotów (TOF).
Dla czytelnika niezaznajomionego z ferrocenami wystarczy powiedzieć, że dwa różne podstawniki w tym samym pierścieniu cyklopentadienylowym dają początek dwóm enancjomerom, które prezentują chiralność planarną (Rysunek 12). Każdy enancjomer jest oznaczany jako R p lub S p (gdzie p oznacza planarny), zgodnie z regułami Schlögla: obserwator patrzy wzdłuż osi C 5 ferrocenu od strony silniej podstawionego pierścienia Cp, a konfiguracja absolutna jest podawana w zależności od najkrótszego łuku schodzącego z pierwszeństwa, zgodnie z ruchem wskazówek zegara lub przeciwnie do ruchu wskazówek zegara.

Origin of planar chirality in ferrocenes (top) (Przedrukowano za pozwoleniem z Organometallics 32:5668-5704. Copyright (2013) American Chemical Society) i reguła Schlögla do identyfikacji enancjomerów (dół).
Sukces Josifosu i jego modyfikacji Xyliphosu pobudził zarówno przemysłowe zastosowania katalizatorów chiralnych, jak i syntezę nowych chiralnych ferrocenów oraz ich zastosowanie w syntezie asymetrycznej . Tak więc, pierwszy Josifos był związkiem macierzystym dla rodziny efektywnych ligandów chiralnych, które znalazły zastosowanie w enancjoselektywnej syntezie innych związków przydatnych w rolnictwie. Dla przykładu, asymetryczne allilowanie trzeciorzędowych α-fluoroketonów, cząsteczek użytecznych w produkcji leków, agrochemikaliów i materiałów funkcjonalnych, przeprowadzono między innymi przy użyciu chiralnych katalizatorów ferrocenylowych (Rysunek 13, ). Niestety, wartości e.e. są zbyt niskie, aby mogły być użyteczne.

Enancjoselektywne allilowanie α-fluoroketonów dla agrochemii, z użyciem chiralnych katalizatorów ferrocenylowych .
Ferroceny w remediacji gleb
Rdzenne gliny pojawiły się jako aktywny składnik gleb, który wpływa na sorpcję kationów, anionów i hydrofobowych organicznych związków chemicznych. Dlatego też ich znaczenie w usuwaniu i zatrzymywaniu zanieczyszczeń wzrasta, również dlatego, że jony żelaza w siatce gliny uczestniczą w reakcjach redoks, które mogą być użyteczne w walce z zanieczyszczeniem jonami metali; na przykład naukowcy z zakładu Hanford w Waszyngtonie mogli zmniejszyć ilość Cr(VI) w dostawie wody z 1 ppm do wartości poniżej limitów wykrywalności (7 do 8 ppb), redukując go do mniej toksycznego i mniej rozpuszczalnego Cr(III), wykorzystując strukturalne żelazo gliny, wcześniej zredukowane do Fe(II).
Do remediacji skażonych gleb coraz większe znaczenie ma stosowanie środków powierzchniowo czynnych. Surfaktanty na bazie ferrocenów mają tę zaletę, że mogą działać zarówno jako środki powierzchniowo czynne, jak i jako związki redoks-aktywne. Dlatego też zastosowano serię ferrocenylowych surfaktantów o różnej długości łańcucha jako interkalanty, w celu określenia warunków, w jakich zachodzi transfer elektronów w glinie strukturalnej Fe. Badania te pozwoliły na uzyskanie lepszej ogólnej wiedzy na temat aktywności Fe w naturalnych krzemianach. Zastosowane jako interkalanty surfaktanty ferrocenylowe (25 i 26 na Rysunku 14a), o różnych długościach łańcucha, zapewniły zarówno zakres potencjałów, jak i zakres możliwych konformacji; jako glinę zastosowano standardowy montmorylonit Wyoming (SWy-1), o wzorze (Al2.88Fe0.68Mg0.47)(Si7.7Al0.29)O20(OH)4, został użyty.

Sole ferrocenylamoniowe stosowane w badaniach związanych z remediacją gleby (a) ref. 52 , b) ref. 53.
The results indicated that ferrocenyl trimethylammonium derivatives with C6 (25) and C11 (26) chains can be oxidized by structural Fe(III) in clay, whereas ferrocenylmethyl trimethylammonium (24) is not oxidized (Figure 15).

Energy scheme for redox reactions of ferrocenyl surfactants with structural Fe(III) in clay .
Later, other ferrocenyl surfactants (27 and 28 in Figure 14b) were used to verify the possibility to exploit them as reversible surfactants . In fact, although the surfactant washing of contaminated soils and groundwater may be an effective approach, operating costs result high and the surfactants need to be recycled, in order to optimize surfactant-enhanced remediation (SER). As discussed in ref. , the methods developed are not satisfactory. Badania wykazały, że solubilizacja benzenu, toluenu i etylobenzenu przy użyciu ferrocenylowych środków powierzchniowo czynnych była lepsza niż w przypadku powszechnie stosowanych kationowych (bromek heksadecylotrimetyloamoniowy (CTABr)) lub anionowych (dodecylosiarczan sodu (SDS)) środków powierzchniowo czynnych. Ponadto, wydajność usuwania była wyższa przy niskich stężeniach ferrocenylowych surfaktantów, a utlenianie do kationu ferrocenowego pozwalało na oddzielenie od związków organicznych, a tym samym na recykling surfaktantu.
Warto wspomnieć, że ferroceny okazały się użyteczne w badaniu właściwości redoks Fe(II) zaadsorbowanego na powierzchniach mineralnych. Pomiar znaczących potencjałów spoczynkowych w systemach środowiskowych i geochemicznych był w przeszłości bardzo trudny, m.in. z powodu powolnego transferu elektronów pomiędzy stałą elektrodą detekcyjną (zwykle Pt) a gatunkiem aktywnym redoks. Zamiast tego, metoda przeniesienia elektronu za pośrednictwem ferrocenu pozwoliła na uzyskanie ruchomych sond w roztworze, które mogą reagować z gatunkami aktywnymi redoks wystarczająco szybko, aby zapewnić mierzalny prąd, dostarczając w ten sposób bezpośrednich pomiarów reaktywności redoks (tj. szybkości przenoszenia elektronów) zaadsorbowanych gatunków aktywnych redoks.
Ferroceny jako czujniki
Pochodne ferrocenu mogą działać zarówno jako czujniki optyczne, jak i elektrochemiczne. Gdy są odpowiednio podstawione, mogą koordynować aniony lub kationy, z konsekwentnym przesunięciem potencjału lub zmianą koloru. Przedstawione zostaną tu tylko wybrane przykłady z ostatnich lat.
- a)
Związki neutralne. Hydrazyna i jej pochodne są stosowane w rolnictwie jako pestycydy, ale dostają się do środowiska również poprzez emisje przemysłowe. Ze względu na ich zagrożenie toksykologiczne, wymagane są czułe, wiarygodne i szybkie metody analityczne. Dostępnych jest wiele technik instrumentalnych, ale te elektroanalityczne mogą zapewnić przenośne, tanie i szybkie procedury, niezależnie od nieco powolnego kinetycznie utleniania hydrazyny. Wykorzystując nanorurki węglowe, elektrokatalityczne oznaczanie fenylohydrazyny i hydrazyny zostało osiągnięte współcześnie, przy użyciu elektrody pasty z nanorurek węglowych modyfikowanych ferrocenem. Taka elektroda okazała się stabilna, łatwa do przygotowania i odnowienia powierzchni. Wykazała ona ulepszoną selektywność i pozwoliła na wykrycie hydrazyny i fenylohydrazyny w tej samej próbce, jednocześnie.
- b) Aniony. Znaczenie asparaginianu jest niezaprzeczalne: jak wiele chiralnych anionów, wchodzi on w procesy biologiczne i chemiczne, nie mówiąc już o przemysłowo ważnym aspartamie. Z drugiej strony, coraz większym zainteresowaniem cieszy się enancjoselektywne rozpoznawanie przez sztuczne cząsteczki gospodarza. Otrzymano szereg 1,1′-disubstytuowanych ferrocenów z chiralnym atomem węgla i podstawnikiem tiomocznikowym i zbadano ich enancjoselektywne rozpoznawanie. Przynajmniej dwa z nich wykazują dobrą rozpoznawalność chiralną, co wykazano na podstawie optycznego miareczkowania L- lub D-N-acetyloasparaginianem w roztworze dimetylosulfotlenku (DMSO). Zmiany koloru są znaczące, jak pokazano na Rysunku 16, co czyni te ferroceny czujnikami kolorymetrycznymi „gołym okiem”.
Figura 16 
Kolorymetryczny czujnik oparty na ferrocenach dla N-acetyloasparaginianu. Od lewej do prawej: pochodna ferrocenylowa powyżej, to samo + L-N-acetyloasparaginian, to samo + D-N-acetyloasparaginian; pochodna ferrocenylowa poniżej, to samo + L-N-acetyloasparaginian, to samo + D-N-acetyloasparaginian. Zaadaptowano z Ref. , Eur J Org Chem 841-849. Przedrukowano za zgodą. Copyright (2009) Wiley.
- c)
Kationy. Wykrywanie kationów metali ciężkich w środowisku ma duże znaczenie, ze względu na ich dyfuzję ze źródeł przemysłowych i ich wpływ na zdrowie. W szczególności, zatrucie ołowiem jest nadal jedną z najczęstszych chorób powodowanych przez środowisko i wykrywanie jonów Pb(II) jest absolutnie konieczne, zwłaszcza w wodzie pitnej. Po tym jak udało się rozpoznać aniony fosforanowe przez ferrocenyloimidazofenantrolinę, która działała zarówno jako czujnik kolorymetryczny jak i elektrochemiczny, ci sami autorzy przygotowali ferroceny podstawione imidazopirydyną (ImPy) lub imidazofenzyną (ImPhen) (Rysunek 17), które działały jako selektywne receptory w stosunku do kationów Pb(II).
Figura 17 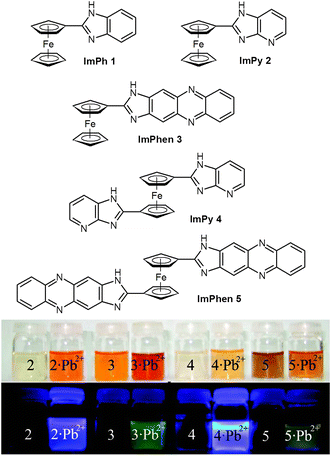
Selektywne wielokanałowe sondy dla kationów Pb(II); zmiany kolorów związane z kompleksowaniem kationów (powyżej, absorpcja, poniżej, emisja). Adaptowano z Ref. J Org Chem 74:4787-4796, przedrukowano za pozwoleniem. Copyright (2009) American Chemical Society.
The compounds, reported in Figure 17, show highly selective affinity for Pb(II) ions over a range of other metal ions, through different channels, i.e., as redox, chromogenic, and fluorescent chemosensors. For example, compound ImP2 showed, upon complexation with Pb(II) cation, an oxidation redox peak anodically shifted (ΔE 1/2 = 150 mV), a red-shifted absorption maximum (Δλ = 44 nm) and an emission with an important chelation-enhanced fluorescence effect.

Ferrocenyl thiourea as electrochemical chemodosimeter for Hg(II) cation .
Inne chemosensory oparte na ferrocenach, jeden selektywny dla kationu Hg(II) i drugi selektywny dla kationu Cu(II), opracowano wprowadzając 1,4-benzenodiaminę 31, 4,4′-bifenylodiaminę 32 lub 4,4′-diaminobenzenisulfid, 33 . Związki te spowodowały powstanie bardzo czułych chemoczujników kolorometrycznych dla Cu(II) i Hg(II), ze zmianami pozwalającymi na detekcję „gołym okiem”, jak widać na Rysunku 19.

