White Paper by Robert L. Wilbur, Pharm.D., CPh | Executive Director, Medical Affairs, Gensco Pharma
Abstract
A helyi gyógyszereket széles körben használják vényköteles vagy vény nélkül kapható (OTC) kezelésekként különböző állapotokra. Bár használatuk gyakori, a lakosság és egyes orvosilag képzett szakemberek körében jelentős zűrzavar uralkodik a helyi és a transzdermális termékek közötti különbséget illetően. Bár minden helyi és transzdermális készítményt a bőrre alkalmaznak, csak a transzdermális készítményeket úgy tervezték, hogy áthatoljanak a bőrrétegen, és kifejtsék hatásukat a mélyebb vagy távolabbi szövetekben. A transzdermális készítmények számos módszert alkalmaznak a Stratum Corneumon, a bőr elsődleges gátján való áthatolás fokozására, lehetővé téve, hogy a gyógyszer megfelelő mennyiségben eljusson a szisztémás keringésbe vagy a mélyebben fekvő szövetekbe. A helyi hatóanyagok csak minimálisan hatolnak be a bőrrétegbe, ami a tervezett céljuk. A transzdermális útvonal használata helyspecifikus kezelést tesz lehetővé, kiküszöbölve vagy minimalizálva a társbetegségekkel, mellékhatásokkal, gyógyszer/gyógyszer kölcsönhatásokkal és mellékhatásokkal kapcsolatos problémákat, amelyek GI-, máj-, vese- vagy egyéb szövődményekhez vezetnek.
Bevezetés
A vegyületeket évezredek óta alkalmazzák a bőrön a szépség fokozására és a helyi állapotok kezelésére. A legtöbb helyileg alkalmazott vegyület és/vagy gyógyszer azonban rosszul vagy egyáltalán nem szívódik fel. Ennek oka a gyógyszermolekula mérete és polaritása, valamint a bőr barrier hatása. Sok vegyületnek a bőrfelszínen kell maradnia (helyileg), mint például a fényvédő szereknek, rovarriasztóknak és fertőtlenítőszereknek, míg mások a bőr rétegeibe hatolva (transzdermálisan) a bőrön belüli vagy közvetlenül a bőr alatti célpontokat célozzák meg.
A közelmúltban fejlesztették ki a transzdermális hatóanyag-leadás technológiáját, hogy számos olyan állapotot kezeljenek, amely a helyi alkalmazási helyen túlmutat. A transzdermális alkalmazás jelentős előnyökkel járhat az orális adagolással szemben, mivel minimális az első áthaladásos metabolizmus, elkerülhető a kedvezőtlen gyomor-bélrendszeri környezet, valamint hosszan tartó és ellenőrzött gyógyszeradagolás biztosítható. Ilyen például a lidokain, a kolhicin, a szkopolamin, az ösztradiol és a tesztoszteron, a nitroglicerin és a fentanil. Ezen előnyök ellenére a legtöbb hatóanyagot molekulaméretük és szerkezetük miatt nem lehet transzdermálisan juttatni.
Megbeszélés
A helyi és a transzdermális kifejezéseket gyakran összekeverik, felváltva használják és rosszul értelmezik. Ez abból a tényből ered, hogy minden, a bőrre alkalmazott gyógyszer definíció szerint helyileg alkalmazott (a bőr felszínén alkalmazott). A lokális gyógyszerelés kifejezés azonban általában olyan, a bőrre alkalmazott gyógyszerekre utal, amelyek a bőrbe való passzív diffúzióra támaszkodnak, és helyi hatást fejtenek ki. Míg a transzdermális gyógyszerek olyan gyógyszerekre utalnak, amelyeket a bőrre alkalmaznak, de olyan bőrpenetrációt fokozó vegyületeket vagy technológiát tartalmaznak, amelyek növelik a bőrgáton átjutni képes gyógyszer mennyiségét, gyakran olyan mértékben, hogy a gyógyszer a szisztémás keringésbe kerülhet, és az alkalmazás helyén kívül más területeken is kifejtheti hatását.
A különbség jobb megértéséhez fontos a bőr és annak gátfunkciójának megértése. A bőr az emberi test legnagyobb szerve, amely a test tömegének nagyjából 10%-át teszi ki. A bőr elsődleges funkciója az, hogy gátat képezzen a test és a külső környezet között. Ez a barrier véd az UV-sugárzástól, a mikroorganizmusoktól, az allergénektől és a vegyi anyagoktól, valamint a víz- és tápanyagveszteségtől. Emellett a bőr számos más funkcióban is részt vesz, például a hőszabályozásban, az anyagcserében és a vérnyomás szabályozásában. A bőr fontos érzékszerv is, amely információkat szolgáltat a környezetről, például a hőmérsékletről, a nyomásról és a káros ingerekről (fájdalom).
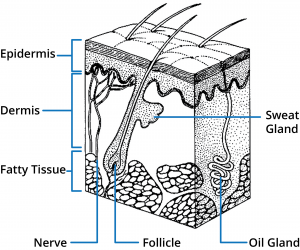 Az emberi bőr három fő régióból áll: a felhámból, a bőrből és a bőr alatti szövetekből. A bőrhöz számos függelék kapcsolódik, beleértve a szőrtüszőket és az ekkrin és apokrin verejtékmirigyeket. A bőrpermeáció szempontjából az epidermisz legkülső rétege, a stratum corneum képezi a fő gátat, ezért e szerkezet megértése alapvető fontosságú az optimális lokális és transzdermális hatóanyag-leadó rendszerek tervezéséhez.
Az emberi bőr három fő régióból áll: a felhámból, a bőrből és a bőr alatti szövetekből. A bőrhöz számos függelék kapcsolódik, beleértve a szőrtüszőket és az ekkrin és apokrin verejtékmirigyeket. A bőrpermeáció szempontjából az epidermisz legkülső rétege, a stratum corneum képezi a fő gátat, ezért e szerkezet megértése alapvető fontosságú az optimális lokális és transzdermális hatóanyag-leadó rendszerek tervezéséhez.
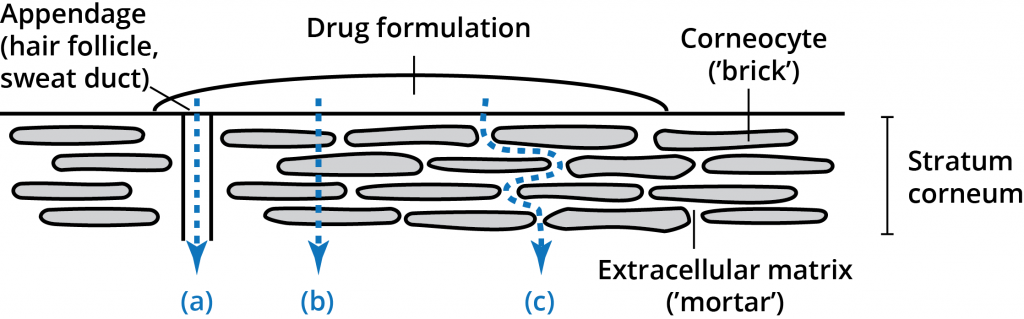
A stratum corneum réteg (a szaruréteg) 10-20 mikrométeres, nagy sűrűségű, alacsony hidratáltságú sejtrétegekből áll. Bár ez a réteg csak 10-15 sejt mélységű, mégis ez az elsődleges barrier. A stratum corneum réteget téglafalszerű struktúraként írták le, amelyben a szarurétegsejtek a “téglák” a sejtek közötti lipidek mátrixában (a “habarcsban”). A stratum corneum intercelluláris lipidek egyedi összetétele és szerkezeti elrendeződésük több lamellás rétegben egy összefüggő lipidtartományon belül kritikus fontosságú a stratum corneum barrier funkciója szempontjából. A bőrre felvitt permeánsnak három lehetséges útvonala van az epidermiszen keresztül: a függelékeken keresztül (a), a szarurétegeken keresztül (b – transzcelluláris útvonal) és a mátrixrétegeken keresztül (c – intercelluláris útvonal). Ezek az útvonalak nem zárják ki egymást, a legtöbb vegyület a permeáló molekula fiziokémiai tulajdonságai alapján az útvonalak kombinációján keresztül hatol a bőrbe.
 Míg az intercelluláris lipid kettősrétegek a szarurétegnek csak egy kis területét foglalják el, ezek biztosítják az egyetlen folyamatos utat a szarurétegen keresztül. Sokéves kutatások bizonyították ennek az útvonalnak a jelentőségét és fontosságát a szarurétegen keresztüli gyógyszerpermeáció szempontjából. Mind a lipid-, mind a poláros molekulák képesek ezen a sejtek közötti úton keresztül szállítani, de a diffúzió mennyisége és sebessége nagymértékben függ a permeáns fiziokémiai tulajdonságaitól.
Míg az intercelluláris lipid kettősrétegek a szarurétegnek csak egy kis területét foglalják el, ezek biztosítják az egyetlen folyamatos utat a szarurétegen keresztül. Sokéves kutatások bizonyították ennek az útvonalnak a jelentőségét és fontosságát a szarurétegen keresztüli gyógyszerpermeáció szempontjából. Mind a lipid-, mind a poláros molekulák képesek ezen a sejtek közötti úton keresztül szállítani, de a diffúzió mennyisége és sebessége nagymértékben függ a permeáns fiziokémiai tulajdonságaitól.
A permeációs folyamat egy sor folyamatot foglal magában, kezdve a permeáns (a gyógyszer) felszabadulásával az adagolási formából (hordozó), majd a diffúzió a szarurétegbe és azon keresztül, majd a vizesebb epidermális környezetbe való szétválás és a mélyebb szövetekbe való diffúzió vagy a bőrkeringésbe való felvétel. Ezek a folyamatok nagymértékben függnek a permeáns oldhatóságától és diffúziós képességétől az egyes környezetekben. A különböző gyógyszermolekulák permeabilitásának e nagyfokú változékonysága miatt számos stratégiát dolgoztak ki a gyógyszerek epidermiszen keresztüli permeációjának megkönnyítésére. A fizikai fokozó módszerek (mikrotűk, szonoferezis, iontoforézis, mikrohorzsolás) nem relevánsak e tárgyalás szempontjából, mivel ezek aktívan megbontják a bőr szerkezetét. A passzív diffúziófokozás két elsődleges módszerrel érhető el: A hatóanyag termodinamikai aktivitásának növelése a készítményekben (szupertelítettség) és olyan kémiai penetrációfokozók (CPE-k) alkalmazása, amelyek kölcsönhatásba lépnek a bőr összetevőivel a hatóanyagáramlás elősegítése érdekében. Míg a szupertelítés még kísérleti fázisban van, a CPE-ket már évtizedek óta széles körben alkalmazzák.
A CPE-k olyan farmakológiailag inaktív vegyületek, amelyek diffundálnak és felosztódnak a bőrben, és reverzibilis kölcsönhatásba lépnek a stratum corneum összetevőivel, különösen a sejtek közötti lipid kettősrétegekkel. Azok az anyagok, amelyek megzavarják a sejtek közötti lipid kettősrétegek erősen rendezett elrendeződését, valószínűleg csökkentik a stratum corneum diffúziós ellenállását a legtöbb gyógyszermolekulával szemben. Ennek hatására pórusok vagy csatornák alakulnak ki a lipid kettősrétegekben, amelyeken a gyógyszermolekulák átjuthatnak. Több száz CPE anyag áll rendelkezésre a gyógyszerhordozó formulázásához, amelyek kiválasztása a permeáns molekula fiziokémiai tulajdonságain, az alkalmazás módján és a bőrkárosodás kockázatán alapul. Egy vagy több CPE megfelelő kiválasztása és formulázása egy adott hatóanyaggal növelheti a hatóanyag transzdermális felszívódását az alkalmazott hatóanyag 1-5%-áról, mint a CPE nélküli helyi alkalmazás esetén, 40%-nál nagyobb arányokra. A bőrön átjutó hatóanyag fokozódása lehetővé teszi a hatóanyag mélyebb szöveti penetrációját és a szisztémás aktivitást biztosító bőrkeringésbe való bejutását.
A mai napig a legtöbb transzdermális gyógyszerhordozó rendszer a tapasz. A tapaszok önmagukban nem fokozzák a gyógyszermolekulák bőrön való áthatolási képességét, de a hosszabb alkalmazási idő miatt növelhetik a gyógyszerfelszívódást. A tapasz formulációs mátrixa, vagy rezervoárja fenntartja a hatóanyag-koncentráció gradiensét az eszközön belül az alkalmazás után, így a hatóanyag-leadás a tapasz és a bőr közötti határfelületre tartósan fennmarad. A tapasz magas gyógyszerkoncentrációja és okkluzív jellege idővel szerény mennyiségű hatóanyagot juttathat át a bőrön, bár az alkalmazott hatóanyag nagy része a tapaszban marad. A CPE-vegyületek és a technológia, például a nanorészecskés adagolórendszerek, köztük a micellák fejlesztésének folyamatos fejlődése megnyitja a transzdermális beadási módot az új és a régi gyógyszerek előtt egyaránt. A micellák olyan lipidmolekulák, amelyek gömb alakban rendeződnek el vizes oldatokban. A micellák kialakulása a zsírsavak amfipatikus természetének köszönhető, ami azt jelenti, hogy egyszerre tartalmaznak hidrofil területeket (poláris fejcsoportok) és hidrofób területeket (a hosszú hidrofób lánc). A micellák poláris fejcsoportokat tartalmaznak, amelyek általában a micellák külső felületét képezik. A víz felé fordulnak, mert polárisak. A hidrofób végcsoportok belül és a víztől távol helyezkednek el, mivel nem polárisak. A micellák képesek a lipofil gyógyszermolekulákat a gömb belsejében megkötni, és lehetővé teszik e molekulák mozgását a poláris környezetben. A Gensco Pharma által létrehozott transzdermális rendszer egy micellákat képző hordozót használ, amely kapszulázza a gyógyszert, és a CPE-kkel kombinálva tovább növeli a permeáció mennyiségét és sebességét. A megnövekedett fluxus lehetővé teszi, hogy a permeáns nagyobb mennyiségben és gyorsabban áthaladjon a bőrgáton, és elérhetővé váljon a mélyebb szövetek és a bőrkeringés számára, mint a tipikus tapaszrendszerek esetében. Azokat a gyógyszereket, amelyek bizonyos állapotokban hatékonyak, de a kedvezőtlen gasztrointesztinális hatások, a magas első átmenő metabolizmus és a rossz biológiai hozzáférhetőség miatt korlátozottan használhatók, most értékelik transzdermális alkalmazásra. A nanorészecskék tervezésével és a bőr hatóanyag-tartályként való felhasználásával megvalósuló ellenőrzött és tartós hatóanyag-leadás forradalmasítja a transzdermális gyógyszeradagolás szemléletét. Most már valóban azt mondhatjuk, hogy a bőrünk is benne van a gyógyszerjátékban.
Következtetés
A bőrpenetráció fokozásának folyamatos fejlődése lehetővé teszi új és régi gyógyszerek transzdermális beadását, ami hosszan tartó terápiás hatást és jobb betegbiztonságot biztosít. A helyi és a transzdermális gyógyszerek közötti formulációs és penetrációs különbségek megértése döntő fontosságú az adott felhasználásra megfelelő termék kiválasztásához. Azoknak a gyógyszereknek, amelyek távoli vagy mélyebb szöveti helyeken kívánnak klinikai hatást kifejteni, célzottan tervezett transzdermális vivőanyagra van szükségük. Ezek a hordozók (gélek, tapaszok, filmek stb.) gyakran tartalmaznak egy vagy több kémiai penetrációfokozót, hogy növeljék a transzdermális penetrációt a kívánt eredmény elérése érdekében. A klinikusnak azonban tisztában kell lennie azzal, hogy nem minden tapasz vagy helyi gél transzdermális. A legtöbb krém, zselé, kenőcs és tapasz csupán helyileg alkalmazható készítmény, és a gyógyszer csak korlátozottan vagy egyáltalán nem hatol be a bőr alatti szövetekbe és keringésbe. A transzdermális gyógyszerek (LiDORx, ColciGel, SpeedGel, Trans-Scop, Androgel stb.) és a helyi készítmények (Lidocain tapaszok, krémek, szteroidkrémek, gombakrémek, antibiotikumok és a legtöbb OTC helyi termék) közötti különbségek megértése lehetővé teszi a beteg számára a legjobb megoldás megfelelő kiválasztását.
Washington C, Washington N. Drug delivery to the skin. In: Physiological Pharmaceutics, Biological Barriers to drug absorption. 1st Ed Ellis Horwood 1989:109-120
Marjukka Suhonen TA, Bouwstra J. Chemical enhancement of percutan absorption in relation to stratum corneum structural changes. J Control Release 1999:59:149-161
Ellias PM. Epidermális lipidek, membránok és keratinizáció. Int J Dermatol 1981:20:1-19
Michaels AS, Shaw JE. Gyógyszerpermeáció az emberi bőrön keresztül: Elmélet és in vitro kísérleti mérés. AIChE J 1975:21:985-996
Barry BW. A bőrpenetráció fokozásának lipidfehérje-megoszlási elmélete. J Control Release 1991:15:237-248
Roberts MS. Célzott gyógyszerbevitel a bőrbe és a mélyebb szövetekbe; Az élettan, az oldott anyagszerkezet és a betegség szerepe. Clin Exp Pharmacol Physiol 1997:24:874-9
Scheuplein RJ. A bőr áteresztőképessége. Physiol Rev 1971:51:702-747
Mitragotri S. Breaking the skin barrier. Adv Drug Deliv Rev 2004:56:555-716
Barry BW. Új mechanizmusok és eszközök a sikeres transzdermális gyógyszerbevitel érdekében. Eur J Pharm Sci 2001:14:101-114
Garavito MR. Detergensek mint a membránbiokémia eszközei. J Biol Chm 2001:276:32403-6