1) Introduktion
Hjärtats utflödeskanal (OFT) är en övergående struktur vid hjärtats arteriella pol som förbinder de embryonala ventriklarna med aortainsäcken. OFT bildas under hjärtslingan från kardiella progenitorceller i pharyngeal mesoderm. Vid sin maximala utbredning är OFT en vriden hjärtmuskelcylinder fodrad med endokardceller, med ortogonala men sammanhängande proximala (conal) och distala (truncal) domäner. OFT omformas därefter i samband med ventrikelseptationen, under vilken process OFT-väggen roterar och delar sig för att bilda basen för den uppstigande aorta och lungstammen. OFT-remodelleringen är förknippad med bildandet av en utloppsseptum, morfogenes av den semilunära klaffen, koronararteriogenes och mognad av myokardiella och glatta muskulaturkomponenter i basen av de stora artärerna. Genetiska eller miljömässiga störningar av OFT:s förlängning och remodellering leder till konotrunala medfödda hjärtfel, som står för 30 % av alla medfödda hjärtfel (cirka 0,3 % av alla levande födda) (Bruneau, 2008; Srivastava och Olson, 2000). Omfattande anatomiska, experimentella och genetiska studier av OFT-morfogenesen har visat att flera celltyper och signalvägar är inblandade i OFT-utvecklingen, vilket tyder på att utvecklingskomplexitet ligger bakom den förhöjda incidensen av OFT-anomalier hos människan.
2) OFT-bildning
Under förlängningen av hjärtröret läggs myokardiet successivt till i hjärtats arteriella pol från en progenitorcellpopulation i faryngeal mesoderm som kallas det andra hjärtfältet (SHF; figur 1A) (Buckingham et al, 2005; Kelly och Buckingham, 2002), (Cai et al., 2003). SHF är placerat i mesodermet medialt men angränsande till celler som ger upphov till det tidiga hjärtröret; senare ligger SHF-cellerna under den ventrala förloppsendodermen och utgör den dorsala väggen i perikardialhålan. SHF bidrar till den högra ventrikeln förutom till hjärtats venösa pol och AV-regioner. Den population av progenitorceller som uteslutande bidrar till den arteriella polen är känd som det främre eller sekundära hjärtfältet. Kritiska transkriptionsreglerare av SHF-utvecklingen har identifierats och omfattar transkriptionsfaktorerna Isl1, Foxh1, Tbx1, Pitx2 och Mef2c (se (Buckingham et al., 2005)). Viktiga egenskaper hos SHF är dess mediala position, differentieringsfördröjning och förhöjd proliferation i förhållande till celler som ger upphov till det tidiga hjärtröret. Dessa egenskaper regleras både intrinsiskt och av omgivande CNC-celler och faryngeal ektoderm och endoderm genom aktiviteten hos signalmolekyler från fibroblasttillväxtfaktorn, benmorfogenetiskt protein, Hedgehog- och Wnt-vägarna (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Tillsammans definierar dessa signaler den nisch som upprätthåller SHF-progenitorcellerna och reglerar deras progressiva utplacering under OFT-utvidgningen (Rochais et al., 2009). OFT kantas av endokardceller som också tros härröra från pharyngeal mesoderm (Laugwitz et al., 2008).
Under förlängningen av hjärtröret läggs myokardiet successivt till vid hjärtats artärpol från en progenitorcellspopulation i pharyngeal mesoderm som benämns det andra hjärtfältet (SHF; figur 1A) (Buckingham et al., 2005; Kelly och Buckingham, 2002), (Cai et al., 2003). SHF är placerat i mesodermet medialt men angränsande till celler som ger upphov till det tidiga hjärtröret; senare ligger SHF-cellerna under den ventrala förloppsendodermen och utgör den dorsala väggen i perikardialhålan. SHF bidrar till den högra ventrikeln förutom till hjärtats venösa pol och AV-regioner. Den population av progenitorceller som uteslutande bidrar till den arteriella polen är känd som det främre eller sekundära hjärtfältet. Kritiska transkriptionsreglerare av SHF-utvecklingen har identifierats och omfattar transkriptionsfaktorerna Isl1, Foxh1, Tbx1, Pitx2 och Mef2c (se (Buckingham et al., 2005)). Viktiga egenskaper hos SHF är dess mediala position, differentieringsfördröjning och förhöjd proliferation i förhållande till celler som ger upphov till det tidiga hjärtröret. Dessa egenskaper regleras både intrinsiskt och av omgivande CNC-celler och faryngeal ektoderm och endoderm genom aktiviteten hos signalmolekyler från fibroblasttillväxtfaktorn, benmorfogenetiskt protein, Hedgehog- och Wnt-vägarna (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Tillsammans definierar dessa signaler den nisch som upprätthåller SHF-progenitorcellerna och reglerar deras progressiva utplacering under OFT-utvidgningen (Rochais et al., 2009). OFT kantas av endokardceller som också tros härröra från pharyngeal mesoderm (Laugwitz et al., 2008).
Under OFT-bildningen förskjuts hjärtats artärpol kaudalt i pharyngealregionen när morfogenesen av pharyngealbågen och bildandet av bilaterala aortabågsartärer äger rum (Waldo et al., 2005b). CNC-celler, som härstammar från det dorsala neuralröret, migrerar genom de kaudala svalgbågarna in i hjärtats OFT under bildandet av den distala regionen av OFT (figur 1B) (Hutson och Kirby, 2003). Förutom en kritisk roll i OFT-remodelleringen spelar CNC-cellerna en tidig roll när det gäller att begränsa proliferationen och kontrollera utplaceringen av SHF (Waldo et al., 2005a). När CNC-cellerna kommer in i den distala OFT genomgår endotelcellerna i OFT:s proximala region en process av epitel- till mesenkymövergång som svar på signaler från myokardiet, för att tillsammans med invaderande neural crest-celler bilda OFT-kuddar mellan myokardie- och endotelskikten (Sugishita et al., 2004b). Konvergensen av OFT-kuddarna i en spiralformad struktur separerar det laminära flödet från den embryonala vänstra och högra ventrikeln. Kuddeutvecklingen är beroende av flera intercellulära signalvägar, inklusive transforming growth factor b, fibroblast growth factor, bone morpogenetic protein, VEGF, Notch och icke-kanonisk Wnt-signalering (Wagner och Siddiqui, 2007). OFT når sin maximala längd vid mitten av graviditeten hos musen (E10,5) eller den fjärde utvecklingsveckan hos människan.
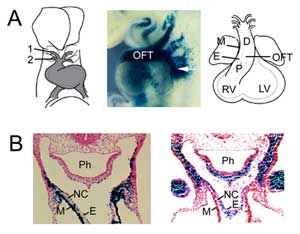
Figur 1
OFT-bildning. (A) OFT vid musens embryonala dag 8,5 är ansluten till den första (1) och andra (2) aortabågen (vänster) och utvidgas genom tillsats av andra hjärtfältets progenitorceller från pharyngeal mesoderm (mitten, pil), visualiserad med en Fgf10 enhancer trap transgen vid E9,5. OFT uppnår maximal längd vid musens embryonala dag 10,5 och består av proximala (P) och distala (D) regioner. (B) Jämförelse av Fgf10-transgenuttryck i OFT och det andra hjärtfältet (vänster) med celler som härstammar från neurallistan (höger) i det distala OFT vid E9,5. Högra panelen reproducerad från Jiang et al., 2001, Development 127:1607-16, med tillstånd. M, myokard, E, endokard, RV, höger kammare, LV, vänster kammare, Ph, pharynx, NC, celler som härstammar från neural crest.
3) OFT-remodellering
Under OFT-remodellering får vänster kammare ett självständigt utlopp, den ascenderande aorta, vilket ger en kritisk systemisk kanal för syresatt blod vid födseln. Den cylindriska OFT omvandlas till basen för den stigande aorta och lungstammen (högerkammarens utlopp) tillsammans med atrioventrikulär septation och ombyggnad av aortabågen mellan dag 10,5 och 14,5 av musens dräktighet. OFT-remodellering är en komplex process med bidrag från både genetik och hemodynamik (Yashiro et al., 2007). De kritiska rollerna för OFT-kuddens utveckling och CNC-cellerna i denna process är fastställda (Sugishita et al., 2004b). Proximalt OFT-myokard införlivas i det ventrikulära utloppet och en process av invasiv myokardialisering leder till muskulisering av det proximala utloppsseptumet (Rana et al., 2007; van den Hoff et al., 2001). Inväxten av det aortopulmonala septumet mellan den fjärde och sjätte aortabågen separerar den distala OFT i den uppåtgående aorta och lungstammen (figur 2A). Glatta muskelväggar utvecklas vid basen av de stora artärerna från det sista bidraget från det andra hjärtfältet och mer distalt från CNCs (Sugishita et al., 2004b; Waldo et al., 2005b).
OFT-septationen åtföljs av rotation av OFT-väggen i motsols riktning, vilket resulterar i att aortan anpassar sig till den vänstra hjärtkammaren och lungstammen till den högra hjärtkammaren (Bajolle et al., 2006). Denna septationsprocess avslutas med konvergens av OFT:s, atrioventrikulära och ventrikulära septa (figur 2A). Den ursprungliga distala OFT-myokardväggen bidrar delvis till högerkammarens subpulmonala myokard och genomgår delvis hypoxi-driven programmerad celldöd under ventrikuloarteriell anpassning (Rana et al., 2007; Sugishita et al., 2004a). Under remodelleringsprocessen bildas semilunära klaffar vid den vinklade korsningen av de proximala och distala regionerna av OFT från den ursprungliga och två interkalerade OFT-kuddar (Anderson et al., 2003). Koronar arteriogenes är den process genom vilken det epikardialt härledda koronarplexus selektivt invaderar basen av aorta ovanför de två klaffbladen som vetter mot lungstammen och bildar ostior som förbinder koronarsystemet med den uppåtgående aorta (figur 2B) (Tomanek, 2005).
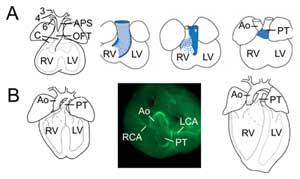
Figur 2.
Outflow tract remodelling. (A) Vid embryonal dag 11,5 är OFT ansluten till den tredje (3), fjärde (4) och sjätte (6) aortabågen (vänster). Det aortopulmonära septumet (APS) separerar den distala OFT i den ascenderande aorta (Ao) och lungstammen (PT) som konvergerar med OFT-kuddarna (C). De tre högra bilderna visar progressiv rotation av myokardväggen under OFT-septationen: den dorsala väggen vid embryodag 10,5 (blått) ger upphov till ventralt subpulmonalt myokard. (B) Vid embryodag 14,5 är OFT-septationen fullständig och aortan är ansluten till vänster ventrikel och lungstammen till höger ventrikel. I en översikt (mitten) avslöjar immunokemi av glatt muskelaktin förbindelserna mellan vänster (LCA) och höger (RCA) kranskärl till basen av aorta. Det slutgiltiga hjärtats struktur (till höger). RV, höger kammare; LV, vänster kammare.
4) Konotrunala medfödda hjärtfel
Den underliggande utvecklingskomplexiteten i OFT-utvecklingen återspeglas i den höga incidensen av konotrunala anomalier hos människan (Bruneau, 2008; Srivastava och Olson, 2000). Bristande SHF- eller CNC-utveckling eller OFT-remodellering bidrar till det spektrum av konotrunala defekter som observerats i mänsklig patologi och djurmodeller (figur 3) (Moon, 2008).
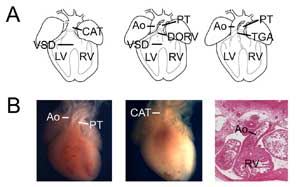
Figur 3.
Angenitala hjärtfel. (A) Teckningar som visar gemensam artärstam (eller persisterande truncus arteriosus, CAT, vänster), höger ventrikel med dubbelt utlopp (DORV, mitten) och transposition av de stora artärerna (TGA, höger). VSD, ventrikelseptumdefekt, RV, höger kammare, LV, vänster kammare, Ao, aorta, PT, lungstam. (B) Exempel på musmodeller av medfödda hjärtfel. Kontrollhjärta som visar aorta och lungstam (vänster) jämfört med ett Tbx1-nollhjärta (mitten) med en enda ventrikelutgång (CAT). Exempel på en höger ventrikel med dubbelt utlopp av transpositionstyp som visar att aortan är ansluten till höger ventrikel i ett Tbx3-nollhjärta (höger).
Om en allvarlig försämring av SHF-utvecklingen leder till misslyckad förlängning av hjärtröret, resulterar lindrigare defekter i ventrikuloarteriella anpassningsanomalier och misslyckande för aortan att etablera en oberoende förbindelse med vänster kammare (Abu-Issa och Kirby, 2007). Dessa defekter kan vara inneboende i SHF eller påverka omgivande celltyper (CNC- eller faryngealepitel) som kontrollerar SHF:s nisch för progenitorceller. Sådana defekter kan resultera i höger ventrikel med dubbelt utlopp, överliggande aorta, lunghypoplasi, lungatresi och fallot-tetralogi. Förlust eller minskning av CNC leder till att OFT-septationen misslyckas eller fördröjs, vilket resulterar i persisterande truncus arteriosus eller dubbel utgången höger kammare. CNC-brist påverkar också indirekt SHF-utvecklingen, vilket resulterar i en sammansatt fenotyp för anpassning och septation (Hutson och Kirby, 2003). Misslyckad rotation av OFT-väggen under OFT-remodellering resulterar också i anpassningsdefekter, inklusive transposition av de stora artärerna, dubbelt utlopp av höger ventrikel och överliggande aorta, vilket ofta följer på defekter i embryonal lateralitet (Bajolle et al., 2006; Bamforth et al., 2001). Defekter i bildandet av OFT-septum kan också bero på senare misslyckad differentiering av myokardväggarna och anomalier i processer som är viktiga för remodellering, t.ex. programmerad celldöd eller myokardialisering (Park et al., 2008). Det har också visats att inneboende defekter i OFT:s endokardceller, liksom hemodynamiska förändringar, leder till OFT-anomalier 16, (Zhang et al., 2009), (Bartman och Hove, 2005; Yashiro et al., 2007). Slutligen är onormal proximal kranskärlsmönster ofta förknippat med konotrundavvikelser och är isolerat en betydande orsak till plötslig hjärtdöd (Angelini et al., 2002). Bland de nuvarande forskningsmålen finns en bättre förståelse av etiologin för conotruncaldefekter genom identifiering av orsakande genetiska mutationer och modifierare genom genomgripande screening och dissektion av det relativa bidraget från genetiska och epigenetiska aktörer i OFT-bildning och remodellering med hjälp av djurmodeller. Dessa studier kommer att ge insikter om de signalvägar och cellulära processer som styr OFT-morfogenesen och som är mål för sjukdomsmekanismer.