Inleiding
Het caudale regressiesyndroom (CRS) is een weinig voorkomende aandoening die voor het eerst werd beschreven door Geoffroy Saint-Hilaire en Hohl in 1852, en in 1964 bedacht Duhmel de term “caudaal regressiesyndroom”.1-3 Het CRS is een aandoening die wordt veroorzaakt door een afwijking van de distale wervelkolomsegmenten, en strekt zich uit tot een breed scala van anomalieën zoals partiële agenese van het ruggenmerg, geassocieerde bekkenmisvormingen, imperforate anus, genitale misvormingen, cardiale anomalieën, bilaterale nierdysplasie of -applasie, pulmonale hypoplasie, en extreme externe rotatie met inferieure gewrichtsfusie, wat in de ernstigste vorm resulteert in sirenomelia (zeemeermin-syndroom). Het CRS wordt ook geassocieerd met femorale hypoplasie, misvormde voeten en flexiecontractuur van de onderste ledematen. De intelligentie blijft in het algemeen behouden.1,2,4 Het treft tussen 0,1 en 0,25 op de 10.000 zwangerschappen, met een man-vrouw verhouding van 2,7:1.3-5 Op embryonaal niveau wordt aangenomen dat CRS het resultaat is van defecten in de inductie van caudale elementen in het embryo vóór de 28e dag van de dracht. Het letsel wordt veroorzaakt in de posterieure mediale mesodermale as waardoor de ontwikkeling van de caudale mesoblastische dooier uitblijft.4,6 De exacte etiologie is onbekend, maar diabetes bij de moeder, genetische aanleg en vasculaire hypoperfusie zijn als mogelijke factoren geopperd.4-7
Pre-gestationele diabetes is zonder twijfel een teratogeen, en er zijn goede aanwijzingen dat zwangerschapsdiabetes betrokken kan zijn bij de ontwikkeling van de ernstigste vorm van CRS.5
Pinter en reece hebben aangetoond dat veranderingen die worden veroorzaakt door hyperglykemie bij het sluiten van de neurale buis onder meer ontregelde cellen, afname van mitose, en veranderingen die wijzen op een voortijdige rijping omvatten. Het door diabetes bij de moeder veranderde oxidatieve metabolisme kan leiden tot een toename van de productie van zuurstofvrije radicalen in het zich ontwikkelende embryo, die teratogeen kunnen zijn.8 Tussen 16% en 22% van de gevallen van CRS wordt in verband gebracht met diabetes mellitus bij de moeder, waardoor het risico op een kind met CRS met wel 400% toeneemt.3,4,7 Er zijn verschillende gevallen van families met CRS gerapporteerd, hetgeen wijst op een mogelijke genetische overdracht met verschillende mogelijke transmissiewijzen: X-gebonden dominant, multifactorieel polygeen, en autosomaal dominante patronen met verminderde penetrantie en variabele expressiviteit.7 De “vasculaire diefstal” theorie werd aanvankelijk voorgesteld door Kampmeier in 1927 en opnieuw geïntroduceerd in 1986 door Stevenson. Adra et al., beschouwden Stevenson’s “vasculaire diefstal” theorie als een mogelijke etiologie van de CRS pathologie.7 Tijdens de embryonale ontwikkelingsfase worden de meer caudale structuren gescheiden van de cephalische elementen zoals de hersenen, de wervelkolom, en het ruggenmerg, vandaar het ontbreken van cognitieve veranderingen bij dit syndroom.4
Er zijn 2 CRS groepen: de eerste groep is het meest getroffen met de beëindiging van het ruggenmerg boven L1. Het heiligbeen eindigt bij S1, en is in sommige gevallen afwezig. Patiënten in de tweede groep vertonen een minder ernstige dysgenese met een lage implantatie van het ruggenmerg en vastgebonden door een verdikt filum terminale of intraspinaal lipoom.4
Casuspresentatie
Wij presenteren de casus van een pasgeboren meisje van een 40-jarige moeder met een medische voorgeschiedenis van onbehandelde uterusmyomen, een achtergrond van onregelmatige gynaecologische cycli, 3 zwangerschappen met 2 bevallingen en een cholecystectomie in 2008. Ze vermeldt een ongeplande maar gewenste zwangerschap, met een hoog risico zwangerschap prenatale zorg. Ze woonde meer dan 15 prenatale consulten bij. Bij de 18e week van de zwangerschap werden compatibele gegevens gevonden met malformaties van de neurale buis met sacrale agenese, resulterend in een CRS-diagnose. Tijdens het tweede trimester van de zwangerschap werd hyperglykemie vastgesteld, daarom werd zij op insulinebehandeling geplaatst. Bij een zwangerschapsduur van 40 weken werd een keizersnede verricht, waarbij een gezond product werd verkregen, met een Apgar-score van 8/9 bij een zwangerschapsduur van 39,6 weken. Bij het lichamelijk onderzoek constateerden wij een gewicht van 3,44 kg, een lengte van 49 cm, een hoofdomtrek van 35 cm en een buikomtrek van 32 cm. Bij inspectie konden we een duidelijke diabetische foetopathie waarnemen, met overvloedig haar, en lage implantatie (Fig. 1). Normale voorste fontanel (2 x 2 cm), rond gezicht, prominente jukbeenderen, horizontale palpebrale fissuren, korte neusbrug, ronde punt, dunne lippen, vol gehemelte, dysplasie van de auriculaire paviljoens met hypertrichosis van de helix, korte hals met een dorsale uitstulping, normale thorax, zonder geruis bij auscultatie, de buik was zacht zonder palpabele massa’s of visceromegalie, lineaire wervelkolom met aanwezigheid van een kuiltje op de huid in de lumbosacrale regio (Fig. 2), geen heiligbeen bot was palpabel, normale positie van de anus, permeabel, met een afwezige toon. Er was een duidelijke verkorting van de onderste ledematen en een bilaterale varus klompvoet (Fig. 3). Er werden röntgenfoto’s genomen om de botafwijkingen te bekijken, en we konden een volledige agenese van het heiligbeen vaststellen met een lumbaal-iliacale fusie. Een magnetische resonantie beeldvorming (MRI) van de hersenen en de wervelkolom (Fig. 4), meldde een abrupte chord en lumbale beëindiging op L3 niveau. Na dit niveau zijn we in staat om alleen amorfe massa’s te identificeren met vet signaal intensiteit, gerelateerd aan onderhuids weefsel. Kort ruggenmerg, vlakke conus medullaris op T10 niveau, beide iliacale botten waren hypoplastisch, en vergroeid op midden niveau. We zijn niet in staat om het heiligbeen te zien. Het was mogelijk om beide nieren malrotated en hypoplastisch te zien, een prominente urineblaas compatibel met een neurogene blaas. Het beeld van de hersenen werd als normaal gerapporteerd. Een echografie van de bovenbuik werd aangevraagd om andere viscerale afwijkingen uit te sluiten, waarbij een discrepantie werd gevonden in de grootte van de linker nier, naast het niet vinden van de normale configuratie, wat duidt op een discrete hypoplasie en een mogelijke malrotatie. Tijdens het verblijf werd multidisciplinair overleg gepleegd en werden aan beide onderste ledematen gipsspalken geplaatst. De patiënt blijft in follow-up bij Urologie, Traumatologie, Neurologie en Algemene Kindergeneeskunde, dit om alle risicofactoren en mogelijke complicaties nauwlettend in het oog te houden.
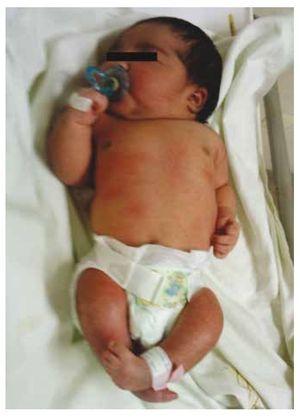
Figuur 1 Pasgeborene met diabetische fetopathie.
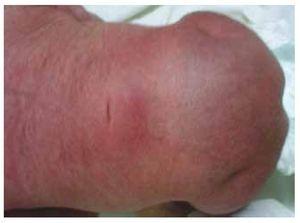
Figuur 2 Een kuiltje op de huid ter hoogte van de lumbosacrale regio.
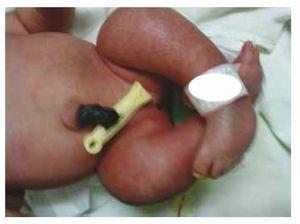
Figure 3 Equinovarus feet.
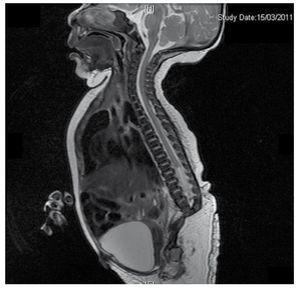
Figure 4 The lumbar spine magnetic resonance imaging (MRI) shows an abrupt chord and lumbar termination at the L3 level. Short spinal cord, flat conus medullaris at T10 level, hypoplastic iliac bones, fused at mid-level. No sacrum is seen.
Discussion
The CRS is a rare congenital malformation. Even though the specific etiologic factor is unknown, it is related to maternal diabetes, genetic predisposition and vascular hypoperfusion.3 Just as in the case presented, this alteration is characterized by agenesis of the sacrum involving iliac and lumbar vertebrae with their corresponding spinal segments and variable abnormalities in the lower limbs as well as in other organs. Fetal diagnosis tools allow early syndrome detection. Prenatale echografie is het meest gebruikte paraklinische instrument; een belangrijk onderdeel van prenatale echografie is de gedetailleerde evaluatie van de wervelkolom en de onderste ledematen; hiermee kan ook de diagnose CRS worden gesteld door het aantonen van een abrupte beëindiging van de lumbale wervelkolom en hypoplastische onderste ledematen. Bij het stellen van een prenatale diagnose moeten we ons richten op het onderscheiden van de mate van digenese en de daarmee samenhangende aangeboren afwijkingen met het oog op het vaststellen van een prognose en een tijdig plan voor postnatale therapeutische ingrepen.3,5 De classificatie van Renshav, die in 1978 tot stand kwam, deelt het syndroom in 4 graden in op basis van de ernst van de agenese van het sacrum, en de betrokkenheid van de iliacale en lumbale wervels.9 Volgens deze classificatie behoort onze patiënte tot graad iV (volledige agenese van het sacrum met iliacale beenfusie). Deze groep wordt geassocieerd met een nog slechtere prognose met een grotere neurologische impact en multisystemische sequenties, voornamelijk op renaal niveau. Dit geval is een duidelijk voorbeeld van het brede scala van veranderingen die de groeiende foetus kan ondervinden als gevolg van ongecontroleerde diabetes van de moeder tijdens de zwangerschap. Gezien de hoge correlatie tussen deze afwijking en de diabetische moeder, en de ontwikkeling ervan in de vroege stadia van de zwangerschap, is het absoluut noodzakelijk een preventieve strategie te hebben die een strikte glycemische controle omvat vóór de embryonale organogenese periode, of zelfs eerder bij hoogrisicopatiënten. Een goede begeleiding en pregestationeel genetisch onderzoek zijn ook belangrijk. De behandeling is een uitdaging voor zowel de arts als de ouders, en vereist een multidisciplinaire aanpak waarbij, afhankelijk van de ernst, een kinderarts, een kinderchirurg, een orthopedisch chirurg, een fysiotherapeut en een uroloog betrokken zijn. Given the fact that the primary pathology is irreversible, treatment is just supportive, with the sole purpose of accomplishing a life as normal as possible.
Conflicts of interest
The authors have no conflicts of interest to declare.
Funding
No financial support was provided.
Received: September 2013;
Accepted: January 2014