Introducere
Sindromul de regresie caudală (SRC) este o tulburare puțin frecventă descrisă pentru prima dată de Geoffroy Saint-Hilaire și Hohl în 1852, iar în 1964 Duhmel a inventat termenul „sindrom de regresie caudală”.1-3 SRC este o tulburare cauzată de o anomalie a segmentelor distale ale coloanei vertebrale și se extinde la o gamă largă de anomalii, cum ar fi agenezia parțială a măduvei spinării, malformații pelviene asociate, anus imperforat, malformații genitale, anomalii cardiace, displazie sau aplasie renală bilaterală, hipoplazie pulmonară și rotație externă extremă cu fuziunea articulațiilor inferioare, rezultând în cea mai gravă formă în sirenomelia (sindromul sirenei). SRC este, de asemenea, asociată cu hipoplazie femurală, picioare deformate și contractură de flexie a membrelor inferioare. Inteligența este păstrată, în general.1,2,4 Afectează între 0,1 și 0,25 din 10.000 de sarcini, cu un raport bărbat-femeie de 2,7:1.3-5 La nivel embrionar, se crede că SRC este rezultatul unor defecte în inducerea elementelor caudale la nivelul embrionului înainte de a 28-a zi de gestație. Leziunea se produce la nivelul axei mezodermice mediale posterioare mediale, cauzând absența dezvoltării vitelor mezoblastice caudale.4,6 Etiologia exactă este necunoscută; cu toate acestea, diabetul matern, predispoziția genetică și hipoperfuzia vasculară au fost sugerate ca factori posibili.4-7
Diabetul pre-gestațional este, fără îndoială, un teratogen și există dovezi solide că diabetul gestațional poate fi implicat în dezvoltarea celei mai severe forme de SRC.5
Pinter și reece au dovedit că alterările induse de hiperglicemie în închiderea tubului neural includ celule dezordonate, scăderea mitozei și modificări care indică o maturare prematură. Metabolismul oxidativ alterat de diabetul matern poate determina o creștere a producției de radicali liberi de oxigen la nivelul embrionului în curs de dezvoltare, care pot fi teratogeni.8 Între 16% și 22% din cazurile de SRC sunt asociate cu diabetul zaharat matern, ceea ce crește riscul de a avea un copil cu SRC cu până la 400.3,4,7 Au fost raportate mai multe cazuri de familii cu SRC, ceea ce sugerează o posibilă transmitere genetică cu diferite moduri posibile de transmitere: modele dominante legate de X, poligenice multifactoriale și autosomal dominante cu penetranță redusă și expresivitate variabilă.7 Teoria „furtului vascular” a fost propusă inițial de Kampmeier în 1927 și reintrodusă în 1986 de Stevenson. Adra și colaboratorii, au considerat teoria „furtului vascular” a lui Stevenson ca fiind o posibilă etiologie a patologiei SRC.7 În timpul stadiului de dezvoltare embrionară, structurile mai caudale sunt separate de elementele cefalice, cum ar fi creierul, coloana vertebrală și măduva spinării, de unde și lipsa alterărilor cognitive în acest sindrom.4
Există 2 grupe de SRC: prima grupă este cea mai afectată, cu terminarea măduvei spinării deasupra L1. Sacrul se termină la S1 și, în unele cazuri, este absent. Pacienții din a doua grupă prezintă o disgeneză mai puțin severă, cu o implantare joasă a măduvei spinării și legată de un filum terminale îngroșat sau de un lipom intraspinal.4
Prezentare de caz
Prezentăm cazul unei fetițe nou-născute de la o mamă în vârstă de 40 de ani cu antecedente medicale de fibroame uterine netratate, un fond de cicluri ginecologice neregulate, 3 sarcini cu 2 nașteri și colecistectomie în 2008. Menționează o sarcină neplanificată, dar dorită, cu o îngrijire prenatală de sarcină cu risc ridicat. A participat la peste 15 consultații prenatale. La a 18-a săptămână de gestație, au fost găsite date compatibile cu malformații ale tubului neural cu agenezie sacrală, rezultând un diagnostic de SRC. În timpul celui de-al doilea trimestru de sarcină a fost depistată hiperglicemie, prin urmare a fost pusă sub tratament cu insulină. La 40 de săptămâni de gestație, s-a efectuat cezariană obținându-se un produs sănătos, cu un scor Apgar de 8/9 cu o vârstă gestațională de 39,6 săptămâni. La examenul fizic s-a observat o greutate de 3,44 kg, o lungime de 49 cm, o circumferință craniană de 35 cm și o circumferință abdominală de 32 cm. În timpul inspecției am putut observa o fetopatie diabetică evidentă, cu păr abundent, și o implantare scăzută (Fig. 1). Fontanela anterioară normală (2 x 2 cm), fața rotundă, pomeți proeminenți, fisuri palpebrale orizontale, punte nazală scurtă, vârf rotund, buze subțiri, palat plin, displazie a pavilioanelor auriculare cu hipertricoză a helixului, gât scurt cu umflătură dorsală, torace normal, fără murmure la auscultație, abdomenul era moale, fără mase palpabile sau visceromegalie, coloana vertebrală liniară cu prezența unei gropițe pe piele în regiunea lombosacrată (Fig. 2), nu era palpabil niciun os sacru, poziția normală a anusului, permeabil, cu un tonus absent. Exista o scurtare evidentă a membrelor inferioare și un picior baston varus bilateral (Fig. 3). S-au făcut radiografii pentru a se vedea malformațiile osoase și am putut observa agenezia completă a sacrului cu o fuziune lombo-iliacă. O imagistică prin rezonanță magnetică (IRM) a creierului și a coloanei vertebrale (Fig. 4), a raportat o coardă abruptă și o terminație lombară la nivelul L3. După acest nivel se pot identifica doar mase amorfe cu intensitate de semnal gras, legate de țesutul subcutanat. Măduva spinării scurtă, conus medullaris plat la nivelul T10, ambele oase iliace erau hipoplazice și fuzionate la nivel mediu. Nu reușim să vedem sacrul. S-a putut vedea ambii rinichi malrotați și hipoplazici, o vezică urinară proeminentă, compatibilă cu o vezică neurogenă. Imaginea cerebrală a fost raportată ca fiind normală. A fost solicitată o ecografie a abdomenului superior pentru a exclude alte anomalii viscerale constatându-se o discretă discrepanță în ceea ce privește dimensiunea rinichiului stâng, pe lângă faptul că nu s-a găsit configurația normală a acestuia, ceea ce a sugerat o hipoplazie discretă, precum și o posibilă malrotație. În timpul șederii s-a efectuat consult multidisciplinar și au fost puse atele ghipsate la ambele membre inferioare. Pacientul rămâne în continuare în monitorizare la Urologie, Traumatologie, Neurologie și Pediatrie generală, asta pentru a urmări îndeaproape toți factorii de risc și eventualele complicații.
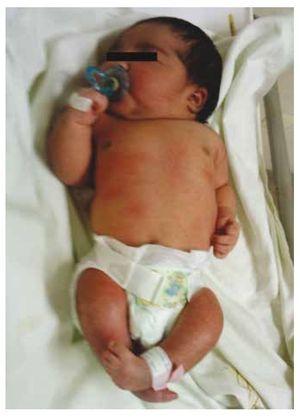
Figura 1 Nou-născut cu fetopatie diabetică.
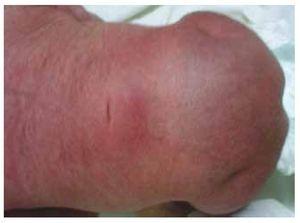
Figura 2 O gropiță pe piele în regiunea lombosacrată.
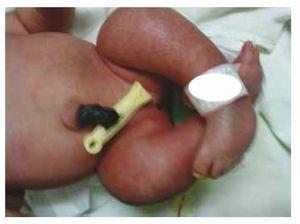
Figure 3 Equinovarus feet.
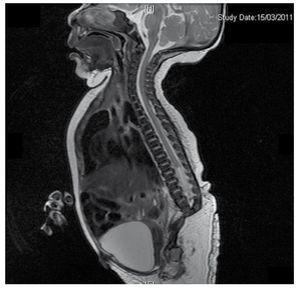
Figure 4 The lumbar spine magnetic resonance imaging (MRI) shows an abrupt chord and lumbar termination at the L3 level. Short spinal cord, flat conus medullaris at T10 level, hypoplastic iliac bones, fused at mid-level. No sacrum is seen.
Discussion
The CRS is a rare congenital malformation. Even though the specific etiologic factor is unknown, it is related to maternal diabetes, genetic predisposition and vascular hypoperfusion.3 Just as in the case presented, this alteration is characterized by agenesis of the sacrum involving iliac and lumbar vertebrae with their corresponding spinal segments and variable abnormalities in the lower limbs as well as in other organs. Fetal diagnosis tools allow early syndrome detection. Ecografia prenatală este instrumentul paraclinic cel mai frecvent utilizat; un element-cheie al ecografiei prenatale este evaluarea detaliată a coloanei vertebrale și a membrelor inferioare; aceasta permite, de asemenea, diagnosticarea SRC prin demonstrarea unei terminații abrupte a coloanei lombare și a membrelor inferioare hipoplazice. Atunci când punem un diagnostic prenatal, trebuie să ne concentrăm pe discernerea gradului de dienezie, precum și a anomaliilor congenitale asociate, cu scopul de a stabili un prognostic și un plan oportun de intervenții terapeutice postnatale.3,5 clasificarea lui renshav, creată în 1978, clasifică sindromul în 4 grade în funcție de severitatea ageneziei sacrului și de implicarea vertebrelor iliace și lombare.9 Conform acestei clasificări, pacienta noastră aparține gradului iV (agenezie completă a sacrului cu fuziunea oaselor iliace). Acest grup se asociază cu un prognostic și mai prost, cu un impact neurologic mai mare și sechele multisistemice, în principal la nivel renal. Acest caz este un exemplu clar al gamei largi de alterări care pot afecta fătul în creștere ca urmare a diabetului matern necontrolat în timpul sarcinii. Din cauza corelației ridicate dintre acest defect și mama diabetică, precum și a dezvoltării sale în timpul primelor etape ale sarcinii, este imperios necesar să existe o strategie preventivă care să includă un control strict al glicemiei înainte de perioada de organogeneză embrionară, sau chiar înainte în cazul pacientelor cu risc ridicat. Orientarea adecvată și examenele genetice pregestaționale sunt, de asemenea, importante. Tratamentul este o provocare atât pentru medic, cât și pentru părinți, și necesită o abordare multidisciplinară care implică un medic pediatru, un chirurg pediatru, un chirurg ortoped, un fizioterapeut și un urolog, în funcție de gravitate. Given the fact that the primary pathology is irreversible, treatment is just supportive, with the sole purpose of accomplishing a life as normal as possible.
Conflicts of interest
The authors have no conflicts of interest to declare.
Funding
No financial support was provided.
Received: September 2013;
Accepted: January 2014